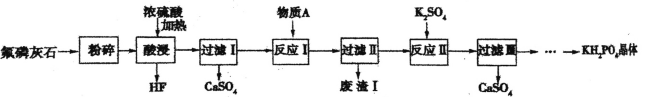
题目内容
【题目】Ⅰ.实验室利用铜和稀硝酸制备一氧化氮:3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O,该反应的离子方程式为___。每生成11.2LNO(标准状况),转移的电子数为___NA。
Ⅱ.(1)在发射“神舟”十一号的火箭推进器中装有肼(N2H4)和过氧化氢,当两者混合时即产生气体,并放出大量的热。已知:
N2H4(l)+2H2O2(l)==N2(g)+4H2O(g) ΔH1;
H2O(l)==H2O(g) ΔH2
请写出液态肼与足量过氧化氢反应生成氮气和液态水的热化学方程式:_____。
(2)在25℃,101kPa下,1molCO完全燃烧放出283.0kJ的热量。请写出表示CO燃烧热的热化学方程式:___。
【答案】3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O 1.5 N2H4(l)+2H2O2(l)=N2(g)+4H2O(l) ΔH=ΔH1-4ΔH2 CO(g)+ ![]() O2(g)=CO2(g) ΔH=-283.0 kJ/mol
O2(g)=CO2(g) ΔH=-283.0 kJ/mol
【解析】
I. 铜和稀硝酸反应,稀硝酸、硝酸铜可拆为离子形式,可写出其离子方程式为3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O,每生成标况下11.2LNO,即生成0.5molNO,转移的电子数为1.5 NA;
II. (1)液态肼与足量过氧化氢反应生成氮气和液态水的方程式为N2H4(l)+2H2O2(l)=N2(g)+4H2O(l),根据盖斯定律,该式可由题目中的上式-4倍的下式得到,即该反应的ΔH=ΔH1-4ΔH2,故热化学方程式为N2H4(l)+2H2O2(l)=N2(g)+4H2O(l) ΔH=ΔH1-4ΔH2;
(2)燃烧热为1mol可燃物完全燃烧生成稳定物质时放出的能量,故表示CO燃烧热的热化学方程式为CO(g)+ ![]() O2(g)=CO2(g) ΔH=-283.0 kJ/mol。
O2(g)=CO2(g) ΔH=-283.0 kJ/mol。