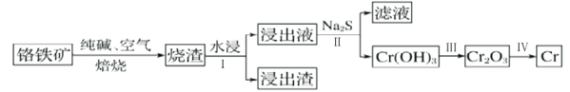
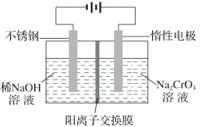
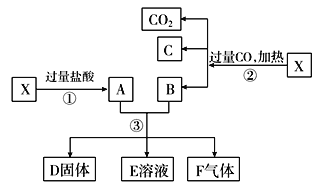
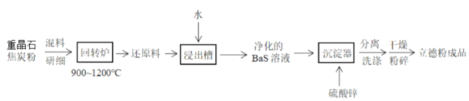
题目内容
【题目】常温下,向100 mL 0.01 mol·L-1HA溶液中逐滴加入0.02 mol·L-1的MOH溶液,如中所示曲线表示混合溶液的pH变化情况。下列说法中正确的是( )
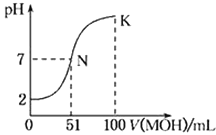
A.HA为一元弱酸,MOH为一元强碱
B.滴入MOH溶液的体积为50 mL时,c(M+)>c(A-)
C.N点水的电离程度大于K点水的电离程度
D.K点时,c(MOH)+ c(M+)=0.02 mol·L-1
【答案】C
【解析】
A.0.01molL-1 HA溶液中pH=2,则HA是强酸,与50mL碱溶液恰好反应后,溶液呈酸性,而与51mL碱恰好反应溶液呈中性,说明碱为弱碱,A错误;
B.MOH是弱碱,滴入MOH溶液的体积为50 mL时,溶液呈酸性,由电荷守恒可知溶液中c(A-)>c(M+),B错误;
C.由图像可知,N点溶液呈中性,水电离的氢离子为10-7mol/L,K点溶液呈碱性,MOH电离的氢氧根离子抑制了水电离,水电离的氢离子小于10-7mol/L,所以N点水的电离程度大于K点水的电离程度,C正确;
D.在K点时混合溶液体积是酸溶液的2倍,物质的量也是HA的2倍,所以c(MOH)+ c(M+)=![]() =0.01 mol·L-1,D错误;
=0.01 mol·L-1,D错误;
故答案选C。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
【题目】有a、b、c、d四个金属电极,有关的反应装置及部分反应现象如下:
实验装置 | 部分实验现象 |
| a极质量减小,b极质量增加 |
| b极有气体产生,c极无变化 |
| d极溶解,c极有气体产生 |
| 电流计指示在导线中电流从a极流向d极 |
由此可判断这四种金属的活动性顺序是( )
A.a>b>c>dB.b>c>d>aC.d>a>b>cD.a>b>d>c