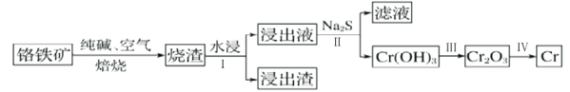
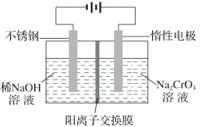
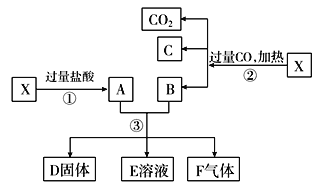
题目内容
【题目】磷酸二氢钾(KH2PO4)是一种重要的化工产品,工业上常用作缓冲剂和培养剂,农业上常用作 复合肥料。以氟磷灰石[主要成分为Ca5F(PO4)3,还含有少量的Fe2O3、A12O3等杂质]为原料制备KH2PO4 晶体的一种流程如下:
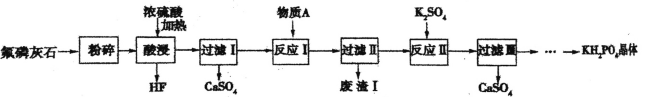
回答下列问题:
(1)“酸浸”过程中生成磷酸的化学方程式为________,若用盐酸代替硫酸,磷酸的产率会明显提高,原因是___,该过程所用的仪器不能釆用二氧化硅陶瓷材料,其主要原因是_____________(用化学方程式表示)。
(2)己知物质A为CaCO3,其作用是调节溶液pH,则“废渣I”的主要成分为__________。
(3) “反应II ”的化学方程式为 _______。
(4)将获得的KH2PO4晶体进行进一步提纯的方法名称为____。
(5)若用1000kg质量分数为50.4%的氟磷灰石来制取磷酸二氢钾晶体,其产率为80%,则生产出的磷酸二氢钾晶体的质量为 _____kg. 已知摩尔质量 M(Ca5F(PO4)3)=504g/mol,M(KH2PO4)=136 g/mol。
【答案】Ca5F(PO4)3+5H2SO4![]() 5CaSO4 ↓ +HF ↑ +3H3PO4 生成的硫酸钙会附着在磷灰石的表面,阻止反应进一步进行 SiO2+4HF═SiF4↑ +2H2O Fe(OH)3、Al(OH)3 K2SO4+Ca(H2PO4)2═2KH2PO4+CaSO4↓ 重结晶 326.4
5CaSO4 ↓ +HF ↑ +3H3PO4 生成的硫酸钙会附着在磷灰石的表面,阻止反应进一步进行 SiO2+4HF═SiF4↑ +2H2O Fe(OH)3、Al(OH)3 K2SO4+Ca(H2PO4)2═2KH2PO4+CaSO4↓ 重结晶 326.4
【解析】
氟磷灰石主要成分为Ca5F(PO4)3,还含有少量的Fe2O3、A12O3等杂质,将氟磷灰石经粉碎后加入浓硫酸,可得到HF气体,过滤得到硫酸钙晶体,滤液中含有磷酸和硫酸铁、硫酸铝,滤液中加入碳酸钙,调节溶液pH,使溶液中的Fe3+、Al3+转化为Fe(OH)3、Al(OH)3沉淀而过滤除去,滤液II中加入K2SO4,进一步除去溶液中的Ca2+,过滤除去CaSO4,将滤液蒸发浓缩、冷却结晶可得到KH2PO4,以此解答该题。
(1)“酸浸”过程中浓硫酸溶解Ca5F(PO4)3,生成磷酸的同时有硫酸钙、HF,则发生反应的化学方程式为Ca5F(PO4)3+5H2SO4![]() 5CaSO4 ↓ +HF ↑ +3H3PO4;因硫酸钙微溶于水,附着在磷灰石的表面,阻止反应进一步进行,因此用盐酸代替硫酸,可明显提高磷酸的产率;该过程生成的HF能腐蚀玻璃,发生反应的化学方程式为SiO2+4HF═SiF4↑ +2H2O,则所用的仪器不能釆用二氧化硅陶瓷材料;
5CaSO4 ↓ +HF ↑ +3H3PO4;因硫酸钙微溶于水,附着在磷灰石的表面,阻止反应进一步进行,因此用盐酸代替硫酸,可明显提高磷酸的产率;该过程生成的HF能腐蚀玻璃,发生反应的化学方程式为SiO2+4HF═SiF4↑ +2H2O,则所用的仪器不能釆用二氧化硅陶瓷材料;
(2)物质A为CaCO3,其作用是调节溶液pH,促进溶液中Fe3+、Al3+完全水解转化为Fe(OH)3、Al(OH)3沉淀,则过滤得到的“废渣I”的主要成分为Fe(OH)3、Al(OH)3;
(3) “反应II”是滤液中加入K2SO4,和Ca(H2PO4)2发生复分解反应生成KH2PO4和CaSO4,发生反应的化学方程式为K2SO4+Ca(H2PO4)2═2KH2PO4+CaSO4↓;
(4)将溶液中获得的KH2PO4晶体进一步提纯,可根据溶解度随温度的变化不同,选择重结晶操作;
(5)若用1000kg质量分数为50.4%的氟磷灰石(化学式为Ca5P3FO12)来制取磷酸二氢钾晶体,其产率为80%,Ca5P3FO12反应的质量为1000kg×50.4%×80%=403.2kg,物质的量为![]() =800mol,则理论上可生产KH2PO4的质量为800mol×136g/mol×3=326400g=326.4kg。
=800mol,则理论上可生产KH2PO4的质量为800mol×136g/mol×3=326400g=326.4kg。

【题目】镧系为元素周期表中第ⅢB族、原子序数为5771的元素。
(1)镝Dy)的基态原子电子排布式为[Xe] 4f106s2,画出镝(Dy)原子价层电子排布图:____________.
(2)高温超导材料镧钡铜氧化物中含有Cu3+,基态时Cu3+的电子排布式为____________。
(3)观察下面四种镧系元素的电离能数据,判断最有可能显示+3价的元素是_____填元素名称)。
几种镧系元素的电离能(单位:kJmol-1)
元素 | Ⅰ1 | Ⅰ2 | Ⅰ3 | Ⅰ4 |
Yb (镱) | 604 | 1217 | 4494 | 5014 |
Lu (镥) | 532 | 1390 | 4111 | 4987 |
La (镧) | 538 | 1067 | 1850 | 5419 |
Ce (铈) | 527 | 1047 | 1949 | 3547 |
(4)元素铈(Ce)可以形成配合物(NH4)2[Ce(NO3)6]。
①组成配合物的四种元素,电负性由大到小的顺序为_______(用元素符号表示)。
②画出氨的最简单气态氢化物水溶液中存在的氢键:________(任写一种)。
③元素Al也有类似成键情况,气态氯化铝分子表示为((AlCl3)2,分子中A1原子杂化方式为_____,分子中所含化学键类型有 _______(填字母)。
a.离子键 b.极性键 c.非极性键 d.配位键
(5)PrO2(二氧化镨)的晶体结构与CaF2相似,晶胞中错原子位于面心和顶点,则PrO2 (二氧化镨)的晶胞中有_____个氧原子;已知晶胞参数为apm,密度为ρgcm-3,NA=_______(用含a、ρ的代数式表示)。