题目内容
【题目】25℃时,CH3COOH的电离常数Ka=1.8×10-5。常温下,往25mL氢氧化钠标准溶液中逐滴加入0.1mol·L-1的CH3COOH溶液,pH变化曲线如图所示:
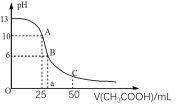
(1)该氢氧化钠溶液的物质的量浓度为__。
(2)A点对应的横坐标为25mL,请用离子方程式解释A点所示的溶液显碱性的原因:__。
(3)A点所示的溶液中各离子浓度由大到小的排列顺序是:______。
(4)B点所示溶液中,![]() =___。
=___。
(5)C点所示溶液为等浓度的CH3COONa和CH3COOH混合溶液,请判断该溶液中c(CH3COOH)__c(CH3COO-)。(填“>”、“<”或“=”)
【答案】0.1 mol·L-1 CH3COO-+HOCHCOOH+OH- c(Na+)>c(CH3COO-)>c(OH-)>c(H+) 18 <
【解析】
(1)该氢氧化钠溶液的物质的量浓度为![]() ;
;
(2)A点为NaOH和醋酸恰好完全反应的点,溶质为醋酸钠,因为醋酸根离子会水解,CH3COO-+HOCHCOOH+OH-,故溶液显碱性;
(3)A点存在电荷守恒c(Na+)+ c(H+)=c(CH3COO-)+c(OH-),因为溶液显碱性,则c(H+)<c(OH-),则c(Na+)>c(CH3COO-),因为溶液中醋酸钠是大量的,氢离子和氢氧根为少量的,故c(Na+)>c(CH3COO-)>>c(OH-)>c(H+);
(4)B点所示溶液中,![]() ;
;
(5)C点所示溶液为等浓度的CH3COONa和CH3COOH混合溶液,pH<7,溶液显酸性,说明醋酸分子的电离程度大于醋酸根离子的水解程度,所以溶液中c(CH3COOH)<c(CH3COO-)。

【题目】镧系为元素周期表中第ⅢB族、原子序数为5771的元素。
(1)镝Dy)的基态原子电子排布式为[Xe] 4f106s2,画出镝(Dy)原子价层电子排布图:____________.
(2)高温超导材料镧钡铜氧化物中含有Cu3+,基态时Cu3+的电子排布式为____________。
(3)观察下面四种镧系元素的电离能数据,判断最有可能显示+3价的元素是_____填元素名称)。
几种镧系元素的电离能(单位:kJmol-1)
元素 | Ⅰ1 | Ⅰ2 | Ⅰ3 | Ⅰ4 |
Yb (镱) | 604 | 1217 | 4494 | 5014 |
Lu (镥) | 532 | 1390 | 4111 | 4987 |
La (镧) | 538 | 1067 | 1850 | 5419 |
Ce (铈) | 527 | 1047 | 1949 | 3547 |
(4)元素铈(Ce)可以形成配合物(NH4)2[Ce(NO3)6]。
①组成配合物的四种元素,电负性由大到小的顺序为_______(用元素符号表示)。
②画出氨的最简单气态氢化物水溶液中存在的氢键:________(任写一种)。
③元素Al也有类似成键情况,气态氯化铝分子表示为((AlCl3)2,分子中A1原子杂化方式为_____,分子中所含化学键类型有 _______(填字母)。
a.离子键 b.极性键 c.非极性键 d.配位键
(5)PrO2(二氧化镨)的晶体结构与CaF2相似,晶胞中错原子位于面心和顶点,则PrO2 (二氧化镨)的晶胞中有_____个氧原子;已知晶胞参数为apm,密度为ρgcm-3,NA=_______(用含a、ρ的代数式表示)。
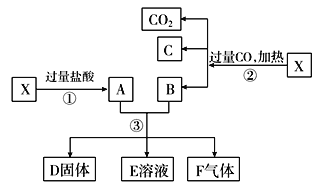
【题目】有a、b、c、d四个金属电极,有关的反应装置及部分反应现象如下:
实验装置 | 部分实验现象 |
| a极质量减小,b极质量增加 |
| b极有气体产生,c极无变化 |
| d极溶解,c极有气体产生 |
| 电流计指示在导线中电流从a极流向d极 |
由此可判断这四种金属的活动性顺序是( )
A.a>b>c>dB.b>c>d>aC.d>a>b>cD.a>b>d>c