题目内容
12.A、B、C、D、E代表5种元素.请填空:(1)A元素基态原子的最外层有3个未成对电子,次外层有2个电子,写出A元素最外层电子的轨道表示式
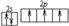 ;A元素形成的气态氢化物中A原子的杂化类型为sp3;
;A元素形成的气态氢化物中A原子的杂化类型为sp3;(2)B元素的负一价离子和C元素的正一价离子的电子层结构都与氩相同,B的元素符号为Cl,C的元素符号为K;
(3)D元素的正三价离子的3d亚层为半充满,D的元素符号为Fe,其基态原子的电子排布式为[Ar]3d64s2.
(4)E元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子,E的元素符号为Cu,其基态原子的电子排布式为[Ar]3d104s1.
分析 根据原子或离子的核外电子排布确定元素的质子数,可确定元素的种类,
(1)A元素基态原子的最外层有三个未成对电子,次外层有2个电子,根据构造原理可知,该元素是N元素,据此书写最外层电子的轨道表示式;根据价层电子对个数=σ键个数+孤电子对个数判断杂化类型;
(2)B元素的负一价离子和C元素的正一价离子的电子层结构都与氩相同,离子核外都有18个电子;
(3)D元素的正三价离子的3d轨道为半充满,电子数为5,应为Fe元素;
(4)E元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子,应为Cu,原子序数为29.
解答 解:(1)基态原子的最外层有3个未成对电子,次外层有2个电子的元素符号为N,其电子排布式为:1s22s22p3,所以最外层电子的轨道表示式为 ,氨气分子中价层电子对个数=σ键个数+孤电子对个数=3+$\frac{1}{2}$(5-3×1)=4,因此N采取sp3杂化,故答案为:
,氨气分子中价层电子对个数=σ键个数+孤电子对个数=3+$\frac{1}{2}$(5-3×1)=4,因此N采取sp3杂化,故答案为: ;sp3;
;sp3;
(2)B元素的负一价离子和C元素的正一价离子的电子层结构都与氩相同,离子核外都有18个电子,阴离子为Cl-,含有Cl元素,阳离子为K+,含有K元素,故答案为:Cl;K;
(3)D元素的正三价离子的3d轨道为半充满,电子数为5,则基态原子的电子排布式为[Ar]3d64s2,应为Fe,故答案为:Fe;[Ar]3d64s2;
(4)E元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子,基态原子的电子排布式为[Ar]3d104s1,应为Cu,故答案为:Cu;[Ar]3d104s1.
点评 本题考查原子核外电子排布,题目难度不大,注意把握原子核外电子的排布规律,学习中注意积累.

练习册系列答案
相关题目
7.膦(PH3)又称磷化氢,在常温下是一种无色有大蒜臭味的有毒气体,电石气的杂质中常含有磷化氢.以下关于PH3的叙述正确的是( )
| A. | PH3分子中有未成键的孤对电子 | B. | PH3是非极性分子 | ||
| C. | 它的分子构型是平面三角形 | D. | 磷原子采用sp2杂化方式 |
4.下列装置或操作能达到实验目的(必要的夹持装置及石棉网已省略)的是( )
| A. |  实验室制乙烯 | |
| B. | 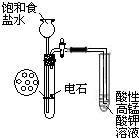 实验室制乙炔并验证乙炔发生氧化反应 | |
| C. | 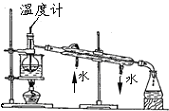 实验室中分馏石油 | |
| D. | 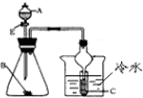 若A为稀硫酸、B为碳酸钠(粉状)、C为苯酚钠溶液,验证稀硫酸、苯酚、碳酸酸性的强弱 |
1.分子式为C5H10O2的有机物A,有果香味,在酸性条件下水解生成有机物B和C,其中C能被催化氧化成醛,则A可能的结构共有( )
| A. | 1种 | B. | 6种 | C. | 9种 | D. | 18种 |