题目内容
1.分子式为C5H10O2的有机物A,有果香味,在酸性条件下水解生成有机物B和C,其中C能被催化氧化成醛,则A可能的结构共有( )| A. | 1种 | B. | 6种 | C. | 9种 | D. | 18种 |
分析 分子式为C5H10O2的有机物A,有果香味,在酸性条件下水解生成有机物B和C,说明C5H10O2是饱和一元酯,形成酯的羧酸与醇的碳原子总数为5,讨论羧酸与醇含有的碳原子,C能被催化氧化成醛,则C属于醇类并且结构中含有-CH2OH结构,据此回答判断.
解答 解:分子式为C5H10O2的有机物A,有果香味,在酸性条件下水解生成有机物B和C,则不属于羧酸类,属于饱和一元酯,
若为甲酸和丁醇酯化,丁醇有4种,其中能氧化为醛的醇有:1-丁醇,2-甲基-1-丙醇,甲酸酯有一种,这样的酯有2种;
若为乙酸和丙醇酯化,丙醇有2种,其中能氧化为醛的醇有:1-丙醇,乙酸只有一种,这样的酯有1种;
若为丙酸和乙醇酯化,乙醇只有1种能氧化互为乙醛,丙酸有1种,这样的酯有1种;
若为丁酸和甲醇酯化,甲醇只有1种,能氧化为甲醛,丁酸有2种,这样的酯有2种;
故A可能的结构共有6种.
故选B.
点评 本题考查同分异构体的书写与判断,难度中等,关键是形成酯的羧酸与醇的同分异构体的判断,注意利用数学法进行计算.

练习册系列答案
相关题目
11.相同物质的量的下列各烃,完全燃烧后消耗氧气最多的是( )
| A. | 甲烷 | B. | 乙烷 | C. | 乙烯 | D. | 乙炔 |
9.用NA表示阿伏伽德罗常数的值,下列叙述正确的是( )
| A. | 1L0.1mol/LNa2CO3溶液中,阴离子总数大于0.1NA | |
| B. | 常温常压下,1mol甘氨酸中含C-H键数目为3NA | |
| C. | 标准状况下,6.72LNO2与水充分反应转移电子数目为0.1NA | |
| D. | 50℃时,10LpH=13的NaOH溶液中含有的OH-数目为NA |
16.
| 苯 | 甲苯 | 乙醇 | 乙烯 | 甲醛 | 苯酚溶液 | |
| 加入饱和溴水,振荡 | 上层变橙红色,下层无色 | 上层变橙红色,下层无色 | 无明显变化 | 褪色 | 褪色 | 白色沉淀 |
| 加入高锰酸钾酸性溶液,振荡 | 溶液分层,上层无色 | 褪色 | 褪色 | 褪色 | 褪色 | 褪色 |
| 新制的Cu(OH)2 | 分层,上层无色 | 分层,上层无色 | 无明显变化 | 红色沉淀 | ||
| 加入一小粒金属钠 | 钠沉到底部,不反应 | 钠沉到底部,不反应 | 放出气体 |
13.柠檬烯是一种食用香料,其结构简式如图,有关柠檬烯的分析正确的是( )
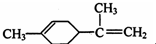

| A. | 柠檬烯的一氯代物有7种 | |
| B. | 柠檬烯和丁基苯互为同分异构体 | |
| C. | 柠檬烯的分子中所有碳原子可能在同一个平面上 | |
| D. | 在一定条件下,柠檬烯可以发生加成、取代、氧化、还原等反应 |
10.太空服以多种金属和胶黏剂作辅料,其中某种金属R可形成R2+.去掉其中可形成离子R2+的某种金属R形成阴离子Q2-,已知该离子的原子核内有n个中子,R原子的质量数为m.则W克该离子共含有的电子为( )
| A. | $\frac{W(m-n)}{m}$mol | B. | $\frac{W(m-n+2)}{m}$mol | C. | $\frac{W(m-n-2)}{m}$mol | D. | $\frac{m-n-2}{Wm}$mol |
11.化学与能源开发、环境保护、生产生活等密切相关.下列说法正确的是( )
| A. | 开发利用可燃冰是缓解能源紧缺的唯一途径 | |
| B. | 将废电池深埋,可以避免其中的重金属污染 | |
| C. | “地沟油”对人体的危害极大,严禁用作食用油 | |
| D. | 生物质能、风能、太阳能等属不可再生资源 |
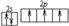 ;A元素形成的气态氢化物中A原子的杂化类型为sp3;
;A元素形成的气态氢化物中A原子的杂化类型为sp3; 煤是重要的能源,也是生产化工产品的重要原料.试用所学知识,解答下列问题:
煤是重要的能源,也是生产化工产品的重要原料.试用所学知识,解答下列问题: