题目内容
3.已知25℃时,a mol/L(NH4)2SO4溶液的pH=5,存在着平衡NH4++H2O?NH3•H2O+H+,则该平衡常数表达式为$\frac{1{0}^{-5}×(1{0}^{-5}-1{0}^{-9})}{2a+1{0}^{-9}-1{0}^{-5}}$(用含a的较为精确的数学表达式表示,不必化简,不做近似计算).分析 根据Kw计算溶液中c(OH-),根据电荷守恒计算溶液中c(NH4+),根据物料守恒计算溶液中c(NH3•H2O),代入平衡常数表达式计算.
解答 解:室温下,在a mol•L-1的(NH4)2SO4水溶液中pH=5,溶液中c(H+)=10-5mol/L,故溶液中c(OH-)=10-9mol/L,根据电荷守恒有:c(NH4+)+c(H+)=c(OH-)+2c(SO42-),即c(NH4+)+10-5mol/L=10-9mol/L+2amol/L,则c(NH4+)=(2a+10-9-10-5)mol/L,根据物料守恒计算溶液中c(NH3•H2O)=2amol/L-(2a+10-9-10-5)mol/L=(10-5-10-9)mol/L,故NH4++H2O?NH3•H2O+H+的平衡常数的表达式为$\frac{1{0}^{-5}×(1{0}^{-5}-1{0}^{-9})}{2a+1{0}^{-9}-1{0}^{-5}}$,
故答案为:$\frac{1{0}^{-5}×(1{0}^{-5}-1{0}^{-9})}{2a+1{0}^{-9}-1{0}^{-5}}$.
点评 本题考查了盐类水解、弱电解质电离平衡、电解质溶液中电荷守恒、物料守恒的分析应用,掌握基础是关键,题目难度中等.

练习册系列答案
 全能测控期末小状元系列答案
全能测控期末小状元系列答案
相关题目
13.工业上,为使95.6%的乙醇变为100%的绝对乙醇,常常加入一种物质加热回流一段时间后蒸馏,得到99.5%的无水乙醇,这种物质是( )
| A. | 无水硫酸 | B. | 无水氯化钙 | C. | 生石灰 | D. | 浓硫酸 |
14.R的气态氢化物为RH3,则R元素最高价氧化物的水化物的化学式可能是( )
| A. | H3RO4 | B. | H2RO4 | C. | HRO4 | D. | H2RO3 |
11.相同物质的量的下列各烃,完全燃烧后消耗氧气最多的是( )
| A. | 甲烷 | B. | 乙烷 | C. | 乙烯 | D. | 乙炔 |
18.下列类推结论中正确的是( )
| A. | 非金属性:F>Cl,则熔点NaF>NaCl | |
| B. | 钠单质与水反应剧烈,锂单质与水反应也十分剧烈 | |
| C. | 干冰(CO2)是分子晶体,则SiO2也是分子晶体 | |
| D. | ⅣA族元素氢化物沸点顺序是:GeH4>SiH4>CH4;则ⅤA族元素氢化物沸点顺序也是:AsH3>PH3>NH3 |
8.有一种AB2C2型分子,在该分子中以A为中心原子.下列有关它的分子构型和有关同分异构体的说法正确的是( )
| A. | 假若为平面四边形,则有三种同分异构体 | |
| B. | 假若为四面体,则有两种同分异构体 | |
| C. | 假若为平面四边形,则无同分异构体 | |
| D. | 假若为四面体,则无同分异构体 |
15.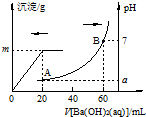 室温时,盐酸和硫酸的混合溶液20mL,向混合物中逐滴加入0.05mol•L-1Ba(OH)2溶液时,生成的BaSO4和pH的变化如图所示(不考虑溶液混合时体积的变化).下列说法正确的是( )
室温时,盐酸和硫酸的混合溶液20mL,向混合物中逐滴加入0.05mol•L-1Ba(OH)2溶液时,生成的BaSO4和pH的变化如图所示(不考虑溶液混合时体积的变化).下列说法正确的是( )
 室温时,盐酸和硫酸的混合溶液20mL,向混合物中逐滴加入0.05mol•L-1Ba(OH)2溶液时,生成的BaSO4和pH的变化如图所示(不考虑溶液混合时体积的变化).下列说法正确的是( )
室温时,盐酸和硫酸的混合溶液20mL,向混合物中逐滴加入0.05mol•L-1Ba(OH)2溶液时,生成的BaSO4和pH的变化如图所示(不考虑溶液混合时体积的变化).下列说法正确的是( )| A. | 图中A点对应溶液的pH:a=1 | |
| B. | 生成沉淀的最大质量m=2.33g | |
| C. | 原混合液中c(HCl)=0.1mol•L-1 | |
| D. | 当V[Ba(OH)2(aq)]=30mL时,有关离子浓度大小:c(Cl-)>c(Ba2+)>c(H+) |
13.柠檬烯是一种食用香料,其结构简式如图,有关柠檬烯的分析正确的是( )
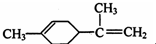

| A. | 柠檬烯的一氯代物有7种 | |
| B. | 柠檬烯和丁基苯互为同分异构体 | |
| C. | 柠檬烯的分子中所有碳原子可能在同一个平面上 | |
| D. | 在一定条件下,柠檬烯可以发生加成、取代、氧化、还原等反应 |
 ;A元素形成的气态氢化物中A原子的杂化类型为sp3;
;A元素形成的气态氢化物中A原子的杂化类型为sp3;