题目内容
20.有机物A是烃的含氧衍生物,在同温同压下,A蒸气对乙醇蒸气的相对密度是2,13.8gA完全燃烧后,若将燃烧的产物通过碱石灰,碱石灰的质量会增加30.6g;若将燃烧产物通过浓硫酸,浓硫酸的质量会增加10.8g.①通过计算确定A的相对分子质量为92,②有机物A的分子式C3H8O3.
分析 在同温同压下,A蒸气对乙醇蒸气的相对密度是2,则A的相对分子质量=46×2=92;
13.8g A完全燃烧后,将燃烧的产物通过碱石灰,碱石灰的质量会增加30.6g为燃烧生成二氧化碳、水的质量,若将燃烧产物通过浓硫酸,浓硫酸的质量会增加10.8g为水的质量,故燃烧生成二氧化碳质量=30.6g-10.8g=19.8g,根据n=$\frac{m}{M}$计算有机物A、水、二氧化碳的物质的量,根据原子守恒计算有机物A分子中C、H原子数目,再根据相对分子质量计算O原子数目,进而确定有机物A的分子式.
解答 解:在同温同压下,A蒸气对乙醇蒸气的相对密度是2,则A的相对分子质量=46×2=92;
13.8g A完全燃烧后,将燃烧的产物通过碱石灰,碱石灰的质量会增加30.6g为燃烧生成二氧化碳、水的质量,若将燃烧产物通过浓硫酸,浓硫酸的质量会增加10.8g为水的质量,故燃烧生成二氧化碳质量=30.6g-10.8g=19.8g,
13.8g A的物质的量=$\frac{13.8g}{92g/mol}$=0.15mol,燃烧生成水的物质的量=$\frac{10.8g}{18g/mol}$=0.6mol,二氧化碳的物质的量=$\frac{19.8g}{44g/mol}$=0.45mol,
根据原子守恒,有机物A分子中C原子数目=$\frac{0.45mol}{0.15mol}$=3、H原子数目=$\frac{0.6mol×2}{0.15mol}$=8,故O原子数目=$\frac{92-12×3-8}{16}$=3,故有机物A的分子式为C3H8O3,
故答案为:92; C3H8O3.
点评 本题考查有机物分子式确定,难度不大,侧重对基础知识的巩固,注意利用原子守恒进行解答.

练习册系列答案
相关题目
10.有一多肽其化学式为C55H70O19N10,将其彻底水解后只得到下列四种氨基酸:
甘氨酸(H2N-CH2COOH),丙氨酸(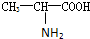 ),苯丙氨酸(
),苯丙氨酸(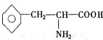 )
)
谷氨酸(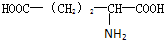 ),则该多肽中所含肽键的数目以及水解后得到的谷氨酸和苯丙氨酸的数目分别是( )
),则该多肽中所含肽键的数目以及水解后得到的谷氨酸和苯丙氨酸的数目分别是( )
甘氨酸(H2N-CH2COOH),丙氨酸(
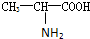 ),苯丙氨酸(
),苯丙氨酸( )
)谷氨酸(
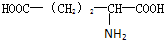 ),则该多肽中所含肽键的数目以及水解后得到的谷氨酸和苯丙氨酸的数目分别是( )
),则该多肽中所含肽键的数目以及水解后得到的谷氨酸和苯丙氨酸的数目分别是( )| A. | 10,4,3 | B. | 10,3,4 | C. | 9,4,3 | D. | 9,3,4 |
11.相同物质的量的下列各烃,完全燃烧后消耗氧气最多的是( )
| A. | 甲烷 | B. | 乙烷 | C. | 乙烯 | D. | 乙炔 |
8.有一种AB2C2型分子,在该分子中以A为中心原子.下列有关它的分子构型和有关同分异构体的说法正确的是( )
| A. | 假若为平面四边形,则有三种同分异构体 | |
| B. | 假若为四面体,则有两种同分异构体 | |
| C. | 假若为平面四边形,则无同分异构体 | |
| D. | 假若为四面体,则无同分异构体 |
15. 室温时,盐酸和硫酸的混合溶液20mL,向混合物中逐滴加入0.05mol•L-1Ba(OH)2溶液时,生成的BaSO4和pH的变化如图所示(不考虑溶液混合时体积的变化).下列说法正确的是( )
室温时,盐酸和硫酸的混合溶液20mL,向混合物中逐滴加入0.05mol•L-1Ba(OH)2溶液时,生成的BaSO4和pH的变化如图所示(不考虑溶液混合时体积的变化).下列说法正确的是( )
 室温时,盐酸和硫酸的混合溶液20mL,向混合物中逐滴加入0.05mol•L-1Ba(OH)2溶液时,生成的BaSO4和pH的变化如图所示(不考虑溶液混合时体积的变化).下列说法正确的是( )
室温时,盐酸和硫酸的混合溶液20mL,向混合物中逐滴加入0.05mol•L-1Ba(OH)2溶液时,生成的BaSO4和pH的变化如图所示(不考虑溶液混合时体积的变化).下列说法正确的是( )| A. | 图中A点对应溶液的pH:a=1 | |
| B. | 生成沉淀的最大质量m=2.33g | |
| C. | 原混合液中c(HCl)=0.1mol•L-1 | |
| D. | 当V[Ba(OH)2(aq)]=30mL时,有关离子浓度大小:c(Cl-)>c(Ba2+)>c(H+) |
5.气态中性原子失去一个电子转化为气态正离子所需要的最低能量叫做第一电离能(I1),气态正离子继续失去电子所需最低能量依次称为第二电离能(I2)、第三电离能(I3)…下表是第三周期部分元素的电离能[单位:eV(电子伏特)]数据.下列说法正确的是( )
| 元素 | I1/eV | I2/eV | I3/eV |
| 甲 | 5.7 | 47.4 | 71.8 |
| 乙 | 7.7 | 15.1 | 80.3 |
| 丙 | 13.0 | 23.9 | 40.0 |
| 丁 | 15.7 | 27.6 | 40.7 |
| A. | 甲的金属性比乙强 | B. | 乙的化合价为+1价 | ||
| C. | 丙一定为金属元素 | D. | 丁一定是金属元素 |
9.用NA表示阿伏伽德罗常数的值,下列叙述正确的是( )
| A. | 1L0.1mol/LNa2CO3溶液中,阴离子总数大于0.1NA | |
| B. | 常温常压下,1mol甘氨酸中含C-H键数目为3NA | |
| C. | 标准状况下,6.72LNO2与水充分反应转移电子数目为0.1NA | |
| D. | 50℃时,10LpH=13的NaOH溶液中含有的OH-数目为NA |
10.太空服以多种金属和胶黏剂作辅料,其中某种金属R可形成R2+.去掉其中可形成离子R2+的某种金属R形成阴离子Q2-,已知该离子的原子核内有n个中子,R原子的质量数为m.则W克该离子共含有的电子为( )
| A. | $\frac{W(m-n)}{m}$mol | B. | $\frac{W(m-n+2)}{m}$mol | C. | $\frac{W(m-n-2)}{m}$mol | D. | $\frac{m-n-2}{Wm}$mol |
 ;A元素形成的气态氢化物中A原子的杂化类型为sp3;
;A元素形成的气态氢化物中A原子的杂化类型为sp3;