题目内容
15.下列实验操作中正确合理的是( )| A. | 用100 mL容量瓶配制50 mL 0.1 mol/L盐酸 | |
| B. | 在托盘天平上称量NaOH时,应将NaOH固体放在小烧杯中称量 | |
| C. | 用25 mL量筒量取4.0 mol/L的盐酸5.62 mL | |
| D. | 用托盘天平准确称取5.85 g NaCl固体 |
分析 A.量筒量液时要注意量程的选择,应选择等于或略大于量取液体体积的量程;
B.氢氧化钠具有强腐蚀性,称量时应该放在小烧杯中快速称量;
C.量筒的最小读数为0.1mL,无法量取5.62mL盐酸;
D.托盘天平的最小读数为0.1g,无法称量5.85g氯化钠固体.
解答 解:A.用100 mL容量瓶配制50 mL 0.1 mol/L盐酸,应选择50mL的量筒,故A错误;
B.氢氧化钠具有腐蚀性,且容易潮解,所以在托盘天平上称量NaOH时,应将NaOH固体放在小烧杯中快速称量,故B正确;
C.量筒最小读数为0.1mL,所以无法用25mL量筒量取4.0mol/L的盐酸5.62mL,故C错误;
D.托盘天平的最小读数为0.1g,无法用托盘天平准确称取5.85g NaCl,只能称量5.9g氯化钠,故D错误;
故选B.
点评 本题考查物质的分离方法以及实验仪器的使用,题目难度不大,注意基础知识的积累.

练习册系列答案
 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案
相关题目
12.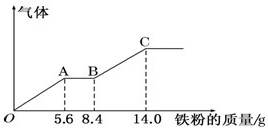 某稀硫酸和稀硝酸的混合溶液200mL,平均分成甲、乙两份.向甲中逐渐加入铜粉,最多能溶解9.6g.向乙中逐渐加入铁粉,产生气体的量随铁粉质量的变化如图所示(已知:Fe+4HNO3(稀)=Fe(NO3)+NO↑+2H2O),下列分析结果不正确的是( )
某稀硫酸和稀硝酸的混合溶液200mL,平均分成甲、乙两份.向甲中逐渐加入铜粉,最多能溶解9.6g.向乙中逐渐加入铁粉,产生气体的量随铁粉质量的变化如图所示(已知:Fe+4HNO3(稀)=Fe(NO3)+NO↑+2H2O),下列分析结果不正确的是( )
 某稀硫酸和稀硝酸的混合溶液200mL,平均分成甲、乙两份.向甲中逐渐加入铜粉,最多能溶解9.6g.向乙中逐渐加入铁粉,产生气体的量随铁粉质量的变化如图所示(已知:Fe+4HNO3(稀)=Fe(NO3)+NO↑+2H2O),下列分析结果不正确的是( )
某稀硫酸和稀硝酸的混合溶液200mL,平均分成甲、乙两份.向甲中逐渐加入铜粉,最多能溶解9.6g.向乙中逐渐加入铁粉,产生气体的量随铁粉质量的变化如图所示(已知:Fe+4HNO3(稀)=Fe(NO3)+NO↑+2H2O),下列分析结果不正确的是( )| A. | 原混合溶液中NO${\;}_{3}^{-}$的物质的量的浓度为4mol/L | |
| B. | AB段的反应为:Fe+2Fe3+=3Fe2+ | |
| C. | C点时,乙中溶质为FeSO4 | |
| D. | 标准状况下,OA,OB段产生的气体总体积约为4.48L |
20.下列叙述正确的是( )
①久置于空气中的氢氧化钠溶液,加盐酸时有气体产生
②用过量的氨水除去Fe3+溶液中的少量Al3+
③Na2O2与CO2反应生成Na2CO3和O2,SO2和Na2O2反应生成Na2SO3和O2
④铝粉与氧化镁共热可制取金属镁
⑤蔗糖炭化的演示实验中,浓硫酸既体现了其强氧化性又体现了其脱水性
⑥氢氧化铁胶体与氯化铁溶液分别蒸干灼烧得相同的物质.
①久置于空气中的氢氧化钠溶液,加盐酸时有气体产生
②用过量的氨水除去Fe3+溶液中的少量Al3+
③Na2O2与CO2反应生成Na2CO3和O2,SO2和Na2O2反应生成Na2SO3和O2
④铝粉与氧化镁共热可制取金属镁
⑤蔗糖炭化的演示实验中,浓硫酸既体现了其强氧化性又体现了其脱水性
⑥氢氧化铁胶体与氯化铁溶液分别蒸干灼烧得相同的物质.
| A. | ①④⑤ | B. | ①⑤⑥ | C. | ②③④ | D. | ④⑤⑥ |
7.设NA是阿伏加德罗常数的数值,下列说法正确的是( )
| A. | 7.8g 苯中含有的单键数目为0.9NA | |
| B. | 1 mol Cl2溶于水,与水反应时电子转移数目为1 NA | |
| C. | 在298K 1.01×105pa下,22 g CO2和N2O混合气体中,所占的体积大于11.2升 | |
| D. | 常温下,pH=13的NaOH溶液中含有的OH-离子数目为0.1NA |
4.对于下列物质中制定元素化合价分析错误的是( )
| A. | 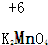 | B. | 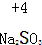 | C. | 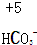 | D. | 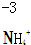 |
5.下列各组物质中,因为反应条件或用量不同而发生不同化学反应的是( )
①C与O2 ②Na与O2 ③Fe与Cl2
④AlCl3溶液与氨水 ⑤CO2与NaOH溶液 ⑥Cu与硝酸.
①C与O2 ②Na与O2 ③Fe与Cl2
④AlCl3溶液与氨水 ⑤CO2与NaOH溶液 ⑥Cu与硝酸.
| A. | 除③外 | B. | 除④外 | C. | 除③④外 | D. | 除②⑥外 |

 某化学研究性学习小组为了解从工业溴中提纯溴的方法,查阅了有关资料,Br2的沸点为59℃,微溶于水,有毒性和强腐蚀性.他们参观生产过程后,组装了如图装置简图:
某化学研究性学习小组为了解从工业溴中提纯溴的方法,查阅了有关资料,Br2的沸点为59℃,微溶于水,有毒性和强腐蚀性.他们参观生产过程后,组装了如图装置简图: