��Ŀ����
����Ŀ�������������в����ķ�ˮ�������ǻ�����Ⱦ����ҪԴͷ���ڻ��������������ǿ�����I2O5��Na2SO3�Ȼ�����Ʒʵ�ֶԷ�ˮ�ͷ�����������
��1������I2O5�������Դ�������H2S���õ�S��I2���ֵ��ʣ�������Ӧ�Ļ�ѧ����ʽΪ________________��
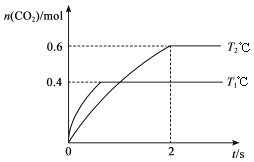
��2������I2O5Ҳ������CO����Ⱦ���䷴Ӧԭ��ΪI2O5(s)+5CO(g)![]() 5CO2(g)+I2(s) ��H����֪�ڲ�ͬ�¶ȣ�T1��T2���£���װ������I2O5�����2 L�����ܱ�������ͨ��2 mol CO�����CO2��������������(CO2)��ʱ��t�ı仯������ͼ��ʾ��
5CO2(g)+I2(s) ��H����֪�ڲ�ͬ�¶ȣ�T1��T2���£���װ������I2O5�����2 L�����ܱ�������ͨ��2 mol CO�����CO2��������������(CO2)��ʱ��t�ı仯������ͼ��ʾ��

���¶�ΪT2ʱ��0��2 min �ڣ�CO2��ƽ����Ӧ���� ��(CO2)=______________��
��b��ʱCO��ת����Ϊ_______����ѧ��Ӧ��ƽ�ⳣ��K=_____�������ʽ����
�۷�Ӧ��I2O5(s)+5CO(g)![]() 5CO2(g)+I2(s)����H______0������>����<������=������
5CO2(g)+I2(s)����H______0������>����<������=������
��������Ӧ��T1�´ﵽƽ��ʱ�����������г������ʵ�����Ϊ2 mol��CO��CO2���壬��ѧƽ��________������������ �������������������ƶ���
�����������Ա�ʾ������Ӧ�ﵽƽ��״̬����____________������ĸ����
A�������ڵ�ѹǿ���ٱ仯 B���������ƽ����Է����������ٱ仯
C����������ܶȲ��ٱ仯 D����λʱ��������CO������CO2�����ʵ���֮��Ϊ1��1
��3��Na2SO3���л�ԭ�ԣ���ˮ��Һ��������Cl2(g)�����ٻ�����Ⱦ��
��֪��Ӧ��
��Na2SO3(aq)+Cl2(g)+H2O(l) ![]() Na2SO4(aq)+2HCl(aq) ��H1=a kJ��mol1
Na2SO4(aq)+2HCl(aq) ��H1=a kJ��mol1
��Cl2(g)+H2O(l) ![]() HCl(aq)+HClO(aq) ��H2=b kJ��mol1
HCl(aq)+HClO(aq) ��H2=b kJ��mol1
��д��Na2SO3(aq)��HClO(aq)��Ӧ���Ȼ�ѧ����ʽ��________________________��
���𰸡� I2O5 + 5 H2S = 5S + I2 + 5H2O 0.15 mol��L-1 ��min-1 80% C5(CO2)/ C5(CO) < ���� BC Na2SO3(aq) + HClO(aq) ![]() Na2SO4(aq) + 2HCl(aq) ��H=��a-b��kJ��mol1
Na2SO4(aq) + 2HCl(aq) ��H=��a-b��kJ��mol1
����������1������I2O5�������Դ�������H2S��H2S������ΪS��I2O5����ԭΪI2�����ݻ��ϼ�������������Լ������غ㶨�ɣ�����д���÷�Ӧ�Ļ�ѧ����ʽΪI2O5 + 5 H2S = 5S + I2 + 5H2O��
��2���÷�Ӧ��һ��������������ֲ���ķ�Ӧ�����Է�Ӧǰ����������ʵ������ֲ��䡣��ͼ���֪����Ӧ��T2ʱ�ȴﵽƽ��״̬������T1<T2���¶�T1�����ߵ�T2����(CO2)��С��˵������Ӧ�Ƿ��ȷ�Ӧ��
���¶�ΪT2ʱ��0��2 min �ڣ���(CO2)��0���ߵ�0.3����CO2�ı仯��Ϊ2mol![]() ��CO2��ƽ����Ӧ������(CO2)=
��CO2��ƽ����Ӧ������(CO2)= ![]() 0.15 mol��L-1 ��min-1��
0.15 mol��L-1 ��min-1��
��b��ʱ��(CO2)=0.8��CO�ı仯��Ϊ0.8![]() ��CO��ת����Ϊ
��CO��ת����Ϊ![]() 80% ������������͵ⶼ�ǹ��壬���Ըû�ѧ��Ӧ��ƽ�ⳣ��K= C5(CO2)/ C5(CO)��
80% ������������͵ⶼ�ǹ��壬���Ըû�ѧ��Ӧ��ƽ�ⳣ��K= C5(CO2)/ C5(CO)��
�۷�Ӧ��I2O5(s)+5CO(g)![]() 5CO2(g)+I2(s)����H<0��
5CO2(g)+I2(s)����H<0��
��������Ӧ��T1�´ﵽƽ��ʱ��c(CO)=0.2mol/L��c(CO2)=0.8mol/L��K= C5(CO2)/ C5(CO)= ![]() �����������г������ʵ�����Ϊ2 mol��CO��CO2���壬Qc=
�����������г������ʵ�����Ϊ2 mol��CO��CO2���壬Qc=![]() <K����ѧƽ�������ƶ���
<K����ѧƽ�������ƶ���
����Ϊ��Ӧǰ��������������䣬���������ڵ�ѹǿ�������仯��CO��CO2�Ļ�ѧ����������ͬ�ģ����Ե�λʱ��������CO������CO2�����ʵ���֮��ʼ��Ϊ1��1��ʼ�ղ�������ݲ�����Ϊƽ��״̬�ı�־���������ƽ����Է��������ͻ�������ܶ��DZ��������Կ��Ա�ʾ������Ӧ�ﵽƽ��״̬���ǻ������ƽ����Է����������ٱ仯�ͻ�������ܶȲ��ٱ仯����BC��
��3����Na2SO3(aq)+Cl2(g)+H2O(l) ![]() Na2SO4(aq)+2HCl(aq) ��H1=a kJ��mol1����Cl2(g)+H2O(l)
Na2SO4(aq)+2HCl(aq) ��H1=a kJ��mol1����Cl2(g)+H2O(l) ![]() HCl(aq)+HClO(aq) ��H2=b kJ��mol1������-�ڵ���Na2SO3(aq) + HClO(aq)
HCl(aq)+HClO(aq) ��H2=b kJ��mol1������-�ڵ���Na2SO3(aq) + HClO(aq) ![]() Na2SO4(aq) + 2HCl(aq)��������H=��a-b��kJ��mol1����
Na2SO4(aq) + 2HCl(aq)��������H=��a-b��kJ��mol1����![]() Na2SO4(aq) + 2HCl(aq) ��H=��a-b��kJ��mol1��
Na2SO4(aq) + 2HCl(aq) ��H=��a-b��kJ��mol1��

 �����������һ��һ��ϵ�д�
�����������һ��һ��ϵ�д� Ӧ������ҵ��ϵ�д�
Ӧ������ҵ��ϵ�д�����Ŀ��ZrO2�������մɲ��ϣ������Ӣɰ(��Ҫ�ɷ�ΪZrSiO4��Ҳ�ɱ�ʾΪZrO2��SiO2������������Fe2O3��Al2O3��SiO2������)ͨ�����·�����ȡ��

��֪����ZrO2�����ռӦ���ɿ�����ˮ��Na2ZrO3��Na2ZrO3���ᷴӦ����ZrO2����
�ڲ��ֽ���������ʵ�������¿�ʼ��������ȫ������pH���±���ʾ��
�������� | Fe3�� | Al3�� | ZrO2�� |
��ʼ����ʱpH | 1.9 | 3.3 | 6.2 |
������ȫʱpH | 3.2 | 5.2 | 8.0 |
(1)�����ڡ�ʱZrSiO4������Ӧ�Ļ�ѧ����ʽΪ________________________________��
(2)�������Ļ�ѧʽΪ________________��
(3)Ϊʹ��Һ���е��������ӳ�����ȫ�����ð�ˮ��pH��a����a�ķ�Χ��________�������Ӱ�ˮ��pH��bʱ����������Ӧ�����ӷ���ʽΪ__________________________________________��
(4)���ˢ�������Һ�м���CaCO3��ĩ�����ȣ��õ��������塣�÷�Ӧ�����ӷ���ʽΪ____________________________��