题目内容
【题目】高铁酸钠(Na2FeO4)易溶于水,是一种新型多功能水处理剂。已知Na2FeO4在强碱性溶液中会析出沉淀。其生产工艺流程如图所示:
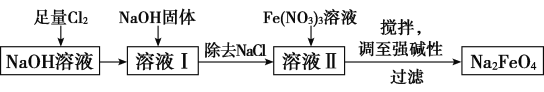
(1)写出向NaOH溶液中通入足量Cl2发生反应的离子方程式:_________________________。
(2)向溶液Ⅱ中加入Fe(NO3)3溶液发生反应,该反应的氧化剂是____________,每制得49.8 g Na2FeO4,理论上消耗氧化剂的物质的量为____________mol。
(3)从环境保护的角度看,制备Na2FeO4较好的方法为电解法,其装置如图甲所示。
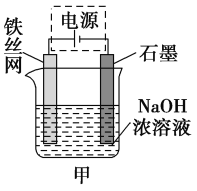
①电解过程中阳极的电极反应式为_______________________。
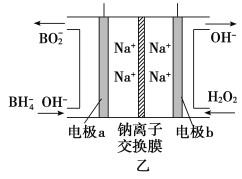
②图甲装置中的电源采用NaBH4(B元素的化合价为+3价)和H2O2作原料的燃料电池,电源工作原理如图乙所示。工作过程中该电源的正极反应式为________________________,Na+由____________(填“a”或“b”,下同)极区移向____________极区。
【答案】(1)2OH-+Cl2=ClO-+Cl-+H2O
(2)NaClO(或次氯酸钠) 0.45
(3)①Fe+8OH--6e-=FeO![]() +4H2O
+4H2O
②H2O2+2e-=2OH- a b
【解析】(1)Cl2与NaOH溶液发生歧化反应生成NaCl、NaClO和H2O,由此可写出离子方程式。(2)结合(1)分析和流程知溶液Ⅱ中溶质主要是NaClO,因此加入Fe(NO3)3溶液后生成Na2FeO4,此反应中,氧化剂为NaClO,还原剂为Fe(NO3)3;利用得失电子守恒得:3NaClO~2Na2FeO4,由此可知生成49.8 g Na2FeO4消耗氧化剂的物质的量为![]() ×
×![]() =0.45 mol。(3)①电解时阳极Fe失电子被氧化为FeO
=0.45 mol。(3)①电解时阳极Fe失电子被氧化为FeO![]() ,结合电解质溶液为碱性可得,阳极电极反应式为Fe+8OH--6e-=FeO
,结合电解质溶液为碱性可得,阳极电极反应式为Fe+8OH--6e-=FeO![]() +4H2O;②电池工作时正极发生还原反应,结合图示原理知正极反应为H2O2得电子,被还原为OH-;电解质溶液中的阳离子(Na+)应由负极区(a极)移向正极区(b极)。
+4H2O;②电池工作时正极发生还原反应,结合图示原理知正极反应为H2O2得电子,被还原为OH-;电解质溶液中的阳离子(Na+)应由负极区(a极)移向正极区(b极)。