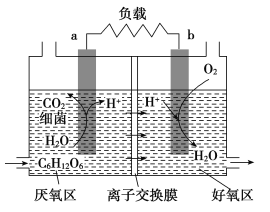
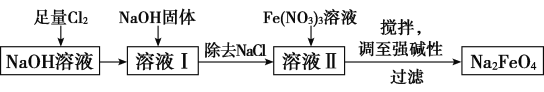
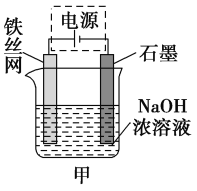
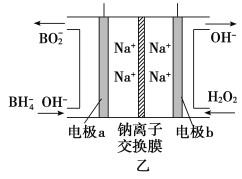
��Ŀ����
����Ŀ������β���У�����NO�ķ�ӦΪ��N2(g)��O2(g) ![]() 2NO(g)��һ�������£������ʵ�����N2(g)��O2(g)�ں����ܱ������з�Ӧ����ͼ����a��ʾ�÷�Ӧ���¶�T��N2��Ũ����ʱ��ı仯������b��ʾ�÷�Ӧ��ijһ��ʼ�����ı�ʱN2��Ũ����ʱ��ı仯������������ȷ����( )
2NO(g)��һ�������£������ʵ�����N2(g)��O2(g)�ں����ܱ������з�Ӧ����ͼ����a��ʾ�÷�Ӧ���¶�T��N2��Ũ����ʱ��ı仯������b��ʾ�÷�Ӧ��ijһ��ʼ�����ı�ʱN2��Ũ����ʱ��ı仯������������ȷ����( )
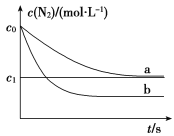
A���¶�T�£��÷�Ӧ��ƽ�ⳣ��K��![]()
B���¶�T�£����ŷ�Ӧ�Ľ��У����������ܶȼ�С
C������b��Ӧ�������ı�����Ǽ����˴���
D��������b��Ӧ�������ı����¶ȣ����жϸ÷�Ӧ�Ħ�H ��0
���𰸡�A
��������ѡA��A.����ͼ���֪N2��O2����ʼŨ��Ϊc0 mol��L��1��ƽ��Ũ��Ϊc1 mol��L��1��NO��ƽ��Ũ��Ϊ2(c0��c1)mol��L��1����ƽ�ⳣ��Ϊ��[2(c0��c1)]2/c��![]() ����ȷ��B.�������ݣ������������䣬���������غ㶨�ɣ���������������䣬����������ܶȲ��䣬����C.����ͼ���֪����b��Ӧ��ƽ��״̬��N2��ƽ��Ũ�ȸ�С��������a��Ȼ�ѧƽ�ⷢ�����ƶ����ı���������Ǽ������������D.��ͼ���֪��ͬʱ��������b��Ӧ�ķ�Ӧ���ʸ���������b��Ӧ�������ı����¶ȣ����¶����ߣ�N2��ƽ��Ũ�ȼ�С����ƽ��������Ӧ�����ƶ������Ը÷�Ӧ�Ħ�H��0������
����ȷ��B.�������ݣ������������䣬���������غ㶨�ɣ���������������䣬����������ܶȲ��䣬����C.����ͼ���֪����b��Ӧ��ƽ��״̬��N2��ƽ��Ũ�ȸ�С��������a��Ȼ�ѧƽ�ⷢ�����ƶ����ı���������Ǽ������������D.��ͼ���֪��ͬʱ��������b��Ӧ�ķ�Ӧ���ʸ���������b��Ӧ�������ı����¶ȣ����¶����ߣ�N2��ƽ��Ũ�ȼ�С����ƽ��������Ӧ�����ƶ������Ը÷�Ӧ�Ħ�H��0������

 ��1����Ԫ�¿�������ĩϵ�д�
��1����Ԫ�¿�������ĩϵ�д�