题目内容
【题目】因瓦合金俗称殷钢,是一种镍铁合金,由于其膨胀系数极小,又称不变合金,适合做测量元件。回答下列问题:
![]() 基态镍原子的价电子轨道表达式为____;铁的基态原子核外未成对电子数为___个。
基态镍原子的价电子轨道表达式为____;铁的基态原子核外未成对电子数为___个。
![]() 丁二酮肟
丁二酮肟![]() 分子式为
分子式为![]() 所含的碳、氮、氧三种元素中第一电离能最大的是_____
所含的碳、氮、氧三种元素中第一电离能最大的是_____![]() 填元素符号
填元素符号![]() 。在稀氨水介质中,
。在稀氨水介质中,![]() 与丁二酮肟
与丁二酮肟![]() 分子式为
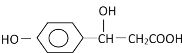
分子式为![]() 反应可生成鲜红色沉淀,其分子结构如图所示,该结构中碳原子的杂化方式为_______;该结构中除含极性键、非极性键、配位键外,还含有__________。
反应可生成鲜红色沉淀,其分子结构如图所示,该结构中碳原子的杂化方式为_______;该结构中除含极性键、非极性键、配位键外,还含有__________。
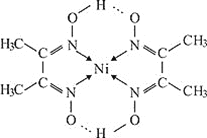
![]() 铁、镍易与CO作用形成羰基配合物
铁、镍易与CO作用形成羰基配合物![]() 、
、![]() 。1个
。1个![]() 分子中含有
分子中含有![]() 键数目为_______;已知
键数目为_______;已知![]() 分子为正四面体构型,下列溶剂能够溶解
分子为正四面体构型,下列溶剂能够溶解![]() 的是_______
的是_______![]() 填写字母
填写字母![]() 。
。
A.四氯化碳 ![]() 苯
苯 ![]() 水
水 ![]() 液氨
液氨
![]() 经查氯化亚铁的熔点为
经查氯化亚铁的熔点为![]() ,沸点为
,沸点为![]() ;而氯化铁的熔点为
;而氯化铁的熔点为![]() ,沸点为
,沸点为![]() 。二者熔沸点差异较大的原因是___________。
。二者熔沸点差异较大的原因是___________。
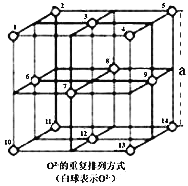
![]() 晶体中,
晶体中,![]() 的重复排列方式如图所示,该排列方式中存在着由如1、3、6、7的
的重复排列方式如图所示,该排列方式中存在着由如1、3、6、7的![]() 围成的正四面体空隙和3、6、7、8、9、12的
围成的正四面体空隙和3、6、7、8、9、12的![]() 围成的正八面体空隙;
围成的正八面体空隙;![]() 中有一半的
中有一半的![]() 填充在正四面体空隙中,另一半
填充在正四面体空隙中,另一半![]() 和
和![]() 填充在正八面体空隙中。则
填充在正八面体空隙中。则![]() 晶体中,正四面体空隙数与
晶体中,正四面体空隙数与![]() 数之比为_______。
数之比为_______。![]() 晶体密度为
晶体密度为![]() ,请计算
,请计算![]() _______
_______![]() 写出计算表达式即可
写出计算表达式即可![]() 。
。
【答案】![]() 4 N
4 N ![]() 、
、![]() 氢键
氢键 ![]() AB 氯化亚铁为离子晶体,而氯化铁为分子晶体
AB 氯化亚铁为离子晶体,而氯化铁为分子晶体 ![]() :1
:1 ![]()
【解析】
(1)基态Ni原子价层电子的排布式为3d84s2,结合泡利原理、洪特规则画出轨道表达式;基态Fe原子核外电子排布式为1s22s22p63s23p63d64s2;
(2)甲基中C原子形成4个σ键、C=N双键中的碳原子形成3个σ键,均没有孤电子对,杂化轨道数目分别为4、3;
(3)Fe与CO形成配位键,CO分子氮气分子互为等电子体,二者结构相似,CO的结构式为C≡O,三键含有2个π键,O原子提供1对电子给C原子,形成1个配位键;Ni(CO)4分子为正四面体构型,属于非极性分子,相似相溶;
(4)镍晶胞为面心立方,顶点Ni原子与面心Ni原子相邻,每个顶点为8个晶胞共用,每个面为2个晶胞共有;由熔点可知,氯化亚铁属于离子晶体,氯化铁属于分子晶体;
(5)由图可知,结构单元中有8个正四面体空隙数,O2-位于图中结构单元的顶点与面心,图中结构单元中O2-数目=8×![]() +6×
+6×![]() =4,根据化合价规则,图中结构单元中有2个Fe3+、1个Fe2+,计算图中结构单元的质量,根据V=
=4,根据化合价规则,图中结构单元中有2个Fe3+、1个Fe2+,计算图中结构单元的质量,根据V=![]() 计算图中结构单元的体积,Fe3O4晶胞中有8个图示结构单元,则晶胞体积为结构单元体积的8倍,8个结构单元形成大的立方体,则该晶胞参数a=
计算图中结构单元的体积,Fe3O4晶胞中有8个图示结构单元,则晶胞体积为结构单元体积的8倍,8个结构单元形成大的立方体,则该晶胞参数a=![]() 。
。
![]() 基态Ni原子价层电子的排布式为
基态Ni原子价层电子的排布式为![]() ,由泡利原理、洪特规则,可得轨道表达式为:
,由泡利原理、洪特规则,可得轨道表达式为:![]() ,基态Fe原子核外电子排布式为
,基态Fe原子核外电子排布式为![]() ,3d轨道有4个电子未成对;
,3d轨道有4个电子未成对;
![]() 因为N的2p轨道是半充满状态较稳定,所以第一电离能最大的元素是N;甲基中C原子形成4个
因为N的2p轨道是半充满状态较稳定,所以第一电离能最大的元素是N;甲基中C原子形成4个![]() 键、
键、![]() 双键中的碳原子形成3个
双键中的碳原子形成3个![]() 键,均没有孤电子对,杂化轨道数目分别为4、3,分别采取
键,均没有孤电子对,杂化轨道数目分别为4、3,分别采取![]() 、
、![]() 杂化;该结构中除含极性键、非极性键、配位键外,还含有氢键;
杂化;该结构中除含极性键、非极性键、配位键外,还含有氢键;
![]() 是中Fe与CO形成5个配位键,CO分子与氮气分子互为等电子体,二者结构相似,CO的结构式为
是中Fe与CO形成5个配位键,CO分子与氮气分子互为等电子体,二者结构相似,CO的结构式为![]() ,其中1个键是O原子提供1对电子给C原子,形成1个配位键,
,其中1个键是O原子提供1对电子给C原子,形成1个配位键,![]() 有5个CO分子,故F
有5个CO分子,故F![]() 分子中有配位键数为
分子中有配位键数为![]() ,
,![]() 分子为正四面体构型,属于非极性分子,相似相溶,能够溶解
分子为正四面体构型,属于非极性分子,相似相溶,能够溶解![]() 的是:四氯化碳、苯,故答案为AB;
的是:四氯化碳、苯,故答案为AB;
![]() 氯化亚铁为离子晶体,熔化时需要破坏离子键,而氯化铁为分子晶体,熔化时需要破坏分子间作用力,二者熔点差别很大;
氯化亚铁为离子晶体,熔化时需要破坏离子键,而氯化铁为分子晶体,熔化时需要破坏分子间作用力,二者熔点差别很大;
![]() 由图可知,结构单元中有8个正四面体空隙数,
由图可知,结构单元中有8个正四面体空隙数,![]() 位于图中结构单元的顶点与面心,图中结构单元中
位于图中结构单元的顶点与面心,图中结构单元中![]() 数目
数目![]() ,
,![]() 晶体中,正四面体空隙数与
晶体中,正四面体空隙数与![]() 数之比为8:
数之比为8:![]() :1;根据化合价规则,图中结构单元中有2个
:1;根据化合价规则,图中结构单元中有2个![]() 、1个
、1个![]() ,图中结构单元的质量
,图中结构单元的质量![]() ,晶体密度为
,晶体密度为![]() ,则图中结构单元的体积
,则图中结构单元的体积![]() ,则该晶胞参数
,则该晶胞参数![]() 。
。