题目内容
9.已知反应:4NH3+5O2═4NO+6H2O(1)若有80gO2参加反应,被氧化的物质是NH3;还原产物是NO和H2O,氧化产物的物质的量为2mol.
(2)反应后,若产生120gNO,则有68g NH3参加反应.
分析 4NH3+5O2═4NO+6H2O中,N元素的化合价由-3价升高为+2,O元素的化合价由0降低为-2价,以此来解答.
解答 解:(1)O元素的化合价降低,则O2为氧化剂,被还原,还原产物为NO和H2O,N元素的化合价升高,失去电子被氧化,氧化产物为NO,所以有80gO2参加反应,氧化产物的物质的量为$\frac{80}{32}$×$\frac{4}{5}$=2mol,
故答案为:NH3;NO和H2O;2;
(2)由方程式可知,4molNH3参加反应时,生成4molNO,则若产生120gNO,则有$\frac{120}{30}$×17=68g NH3参加反应,故答案为:68.
点评 本题考查氧化还原反应及计算,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应基本概念及计算的考查,题目难度不大.

练习册系列答案
相关题目
16.下列事实中,与电化学腐蚀无关的是( )
| A. | 减少钢铁中的含碳量,可以增强钢铁的耐腐蚀能力 | |
| B. | 纯银打造的饰品放置一段时间后表面会生成一层黑色物质 | |
| C. | 为保护海轮的船壳,常在船壳上镶入锌块 | |
| D. | 镀银的铁制品,镀层部分受损后,露出的铁表面更易被腐蚀 |
20.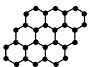 金刚石晶体结构中,每个碳原子与周围四个碳原子形成正四面体空间立体网状结构,则金刚石晶体中碳原子数与共价键之比是( )
金刚石晶体结构中,每个碳原子与周围四个碳原子形成正四面体空间立体网状结构,则金刚石晶体中碳原子数与共价键之比是( )
 金刚石晶体结构中,每个碳原子与周围四个碳原子形成正四面体空间立体网状结构,则金刚石晶体中碳原子数与共价键之比是( )
金刚石晶体结构中,每个碳原子与周围四个碳原子形成正四面体空间立体网状结构,则金刚石晶体中碳原子数与共价键之比是( )| A. | 1:2 | B. | 2:1 | C. | 1:4 | D. | 4:1 |
4.如图为元素周期表中短周期的一部分,若X原子次外层电子数比最外层电子数多3,则下列说法正确的是( )
| R | ||
| X | Y | Z |
| A. | X的氢化物比R的氢化物稳定 | |
| B. | 原子半径大小顺序是Z>Y>X | |
| C. | Y元素能形成两种常见的含氧酸,其中一种是强酸 | |
| D. | XZ5分子中各原子均满足最外层8电子结构 |
1.关于麻黄碱的说法错误的是( )
| A. | 麻黄碱是国际奥委会严格禁止使用的兴奋剂 | |
| B. | 麻黄碱是从中药中提取的天然药物 | |
| C. | 麻黄碱能使人兴奋,运动员服用后能超水平发挥 | |
| D. | 麻黄碱有镇静催眠的效果 |
18.金属钛对人体无毒且有惰性,能与肌肉和骨骼生长在一起,因而有“生物金属”之称.下列有关${\;}_{22}^{48}$Ti和${\;}_{22}^{50}$Ti的说法中正确的是( )
| A. | ${\;}_{22}^{48}$Ti和${\;}_{22}^{50}$Ti原子中均含有22个中子 | |
| B. | ${\;}_{22}^{48}$Ti和${\;}_{22}^{50}$Ti核外电子数相等 | |
| C. | 分别由${\;}_{22}^{48}$Ti和${\;}_{22}^{50}$Ti组成的金属钛单质互称为同位素 | |
| D. | ${\;}_{22}^{48}$Ti与${\;}_{22}^{50}$Ti为同一核素 |
19.下列物质中存在顺反异构体的是( )
| A. | 2-氯丙烯 | B. | 丙烯 | C. | 2,3-二氯-2-戊烯 | D. | 1-丁烯 |
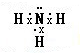 ,它的化学键属于极性键;含有离子键和共价键的化合物的化学式为Na2O2.
,它的化学键属于极性键;含有离子键和共价键的化合物的化学式为Na2O2. .
.