题目内容
2.随着化石能源的减少,新能源的开发利用日益迫切.(1)Bunsen热化学循环制氢工艺由下列三个反应组成:
SO2(g)+I2(g)+2H2O(g)=2HI (g)+H2SO4(l)△H=a kJ•mol-1
2H2SO4(l)=2H2O(g)+2SO2(g)+O2(g)△H=b kJ•mol-1
2HI(g)=H2(g)+I2(g)△H=c kJ•mol-1
则:2H2O(g)=2H2(g)+O2(g)△H=(2a+b+2c)kJ•mol-1
(2)已知在101kPa时,CH4完全燃烧生成1mol液态水,放出的热量为QkJ,则CH4完全燃烧反应的热化学方程式是:CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-2QkJ•mol-1 .
(3)1molN2(g)和1molO2(g)在一定条件下反应生成2molNO(g),吸收180kJ的热量,已知断裂1molN2(g)中的N≡N和1molO2(g)中的O=O分别需要吸收946kJ和498kJ的能量,则1molNO分子中的化学键形成时可释放632kJ的能量.
分析 (1)依据盖斯定律,将所给的反应根据目标反应做相应的变形后做相应的加减,反应热也做相应的变化即可解得;
(2)CH4完全燃烧生成1mol液态水,放出的热量为QkJ,则生成2mol液态水放出2QkJ的热量;
(3)根据反应热与键能的计算关系计算反应热.
解答 解:(1)①SO2(g)+I2(g)+2H2O(g)=2HI (g)+H2SO4(l)△H=a kJ•mol-1
②2H2SO4(l)=2H2O(g)+2SO2(g)+O2(g)△H=b kJ•mol-1
③2HI(g)=H2(g)+I2(g)△H=c kJ•mol-1
依据盖斯定律①×2+②+③×2得到2H2O(g)=2H2(g)+O2(g)△H=(2a+b+2c)KJ/mol,故答案:(2a+b+2c);
(2)CH4完全燃烧生成1mol液态水,放出的热量为QkJ,则生成2mol液态水放出2QkJ的热量,则甲烷的燃烧热化学反应方程式为CH4(g)+2O2(g)═CO2(g)+2H2O (l)△H=-2Q kJ•mol-1,故答案为:CH4(g)+2O2(g)═CO2(g)+2H2O (l)△H=-2Q kJ•mol-1 .
(3)化学反应中断裂化学键要吸热,形成新化学键要放热,则有
断裂1molN2(g)中的N≡N和1molO2(g)中的O=O共吸收的能量为:946kJ+498kJ=1444kJ,
设1molNO分子中的化学键形成时可释放xkJ的能量,
则有:1444kJ-2xkJ=180kJ,x=632,
故答案为:632.
点评 本题综合考查盖斯定律的运用以及热化学方程式的书写和计算等问题,本题难度中等,注意从化学键的角度计算反应热的方法.

练习册系列答案
相关题目
12.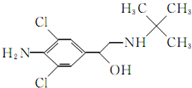 食品安全是现今百姓生活中热议问题之一,瘦肉精学名盐酸克伦特罗,白色或类白色的结晶粉末,无臭、味苦,熔点161℃,溶于水、乙醇,微溶于丙酮,不溶于乙醚.其结构简式如图.有关瘦肉精的说法不正确的是( )
食品安全是现今百姓生活中热议问题之一,瘦肉精学名盐酸克伦特罗,白色或类白色的结晶粉末,无臭、味苦,熔点161℃,溶于水、乙醇,微溶于丙酮,不溶于乙醚.其结构简式如图.有关瘦肉精的说法不正确的是( )
 食品安全是现今百姓生活中热议问题之一,瘦肉精学名盐酸克伦特罗,白色或类白色的结晶粉末,无臭、味苦,熔点161℃,溶于水、乙醇,微溶于丙酮,不溶于乙醚.其结构简式如图.有关瘦肉精的说法不正确的是( )
食品安全是现今百姓生活中热议问题之一,瘦肉精学名盐酸克伦特罗,白色或类白色的结晶粉末,无臭、味苦,熔点161℃,溶于水、乙醇,微溶于丙酮,不溶于乙醚.其结构简式如图.有关瘦肉精的说法不正确的是( )| A. | 化学式为C12H18ONCl2 | |
| B. | 遇FeCl3溶液发生显色反应 | |
| C. | 属于芳香族化合物 | |
| D. | 可以发生取代、加成、水解、酯化、消去反应 |
10.硒是人体肝脏和肾脏的组成元素之一,现在含有元素硒(Se)的保健品已经进入市场,已知它与氧元素同主族,与K同周期,关于硒的说法中不正确的是( )
| A. | 原子序数为34 | B. | 还原性:H2Se<H2S | ||
| C. | 酸性:H2SeO4<HBrO4 | D. | 稳定性:H2Se>AsH3 |
17.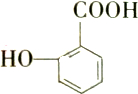 有多种同分异构体,其中能发生银镜反应,遇三氯化铁溶液发生显色反应,但不水解的芳香族化合物共有( )
有多种同分异构体,其中能发生银镜反应,遇三氯化铁溶液发生显色反应,但不水解的芳香族化合物共有( )
 有多种同分异构体,其中能发生银镜反应,遇三氯化铁溶液发生显色反应,但不水解的芳香族化合物共有( )
有多种同分异构体,其中能发生银镜反应,遇三氯化铁溶液发生显色反应,但不水解的芳香族化合物共有( )| A. | 4种 | B. | 5种 | C. | 6种 | D. | 7种 |
11.下列关于乙炔制取的说法不正确的是( )
| A. | 为了加快反应速率可用饱和食盐水代替水反应 | |
| B. | 此反应是放热反应 | |
| C. | 反应中不需加碎瓷片作沸石 | |
| D. | 为了除去杂质气体,除了用硫酸铜外还可用氢氧化钠溶液 |
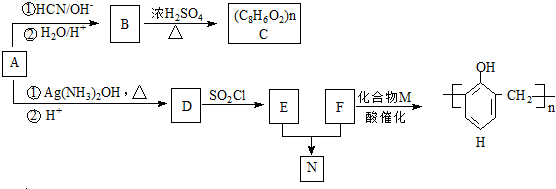
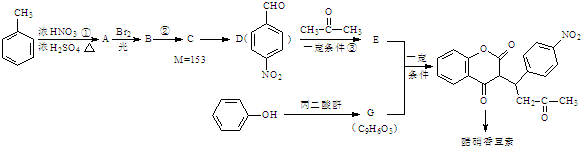
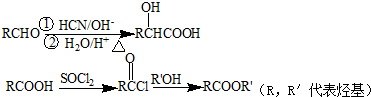 (R,R′代表烃基)
(R,R′代表烃基)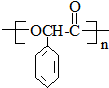 ,M的结构式
,M的结构式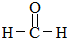 .
. .
.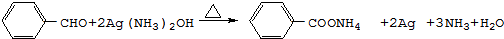 .
.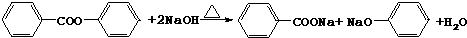 .
.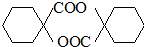 ,其它无机试剂任选.
,其它无机试剂任选.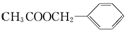 )广泛存在于可可、咖啡、草莓等物质中,可用作食物和日化用品的香精.
)广泛存在于可可、咖啡、草莓等物质中,可用作食物和日化用品的香精.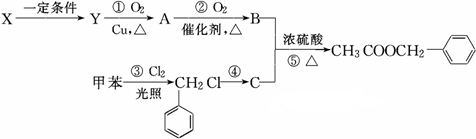
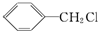 发生反应④的化学方程式为
发生反应④的化学方程式为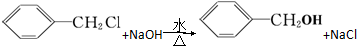 ,该反应的反应类型为水解反应.
,该反应的反应类型为水解反应.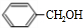 $?_{△}^{浓硫酸}$
$?_{△}^{浓硫酸}$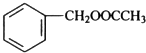 +H2O.
+H2O.
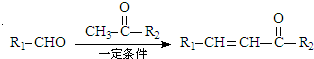 +H2O
+H2O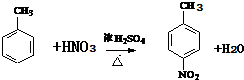 .
.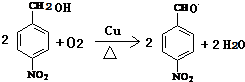 .
. .
.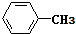 互为同系物;
互为同系物;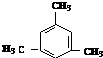 .
.