题目内容
7.A、B、C、D均为含有18个电子且由两种短周期元素组成的化合物分子,它们分子中所含原子的数目依次为2、3、4、6.A和C分子中的原子个数比为1:1,B和D分子中的原子个数比为1:2.D可作为火箭推进剂的燃料.请回答下列问题:(1)C、D分子中相对原子质量较大的两种元素中第一电离能较大的是N(用元素符号回答);从原子结构角度解释原因是N原子2P能级电子排布为半充满状态,较稳定.
(2)B的空间构型为V形,该分子属于极性分子(填“极性”或“非极性”),D分子中心原子的杂化方式是sp3.
(3)C为一种绿色氧化剂,有广泛应用,Cu、氨水与C反应生成深蓝色溶液,在该深蓝色的浓溶液中加入乙醇所产生的现象是析出深蓝色晶体.写出Cu、氨水、C反应的离子方程式:Cu+4NH3•H2O+H2O2=[Cu(NH3)4]2++4H2O+2OH-.
分析 均由两种短周期元素组成的A、B、C、D化合物分子,都含有18个电子,它们分子中所含原子的数目依次为2、3、4、6,A和C分子中的原子个数比为1:1,则A是HCl,C是H2O2,B和D分子中的原子个数比为1:2,则B是H2S,D可作为火箭推进剂的燃料,则D是N2H4,结合物质的结构和性质解答.
解答 解:均由两种短周期元素组成的A、B、C、D化合物分子,都含有18个电子,它们分子中所含原子的数目依次为2、3、4、6,A和C分子中的原子个数比为1:1,则A是HCl,C是H2O2,B和D分子中的原子个数比为1:2,则B是H2S,D可作为火箭推进剂的燃料,则D是N2H4,
(1)C、D分子中相对原子质量较大的两种元素为N和O,根据同一周期中,元素的第一电离能随着原子序数的增大而呈增大的趋势,但N原子2P能级电子排布为半充满状态,较稳定,所以第一电离能大小顺序是N>O,
故答案为:N;N原子2P能级电子排布为半充满状态,较稳定;
(2)B是H2S,硫化氢分子中硫原子含有2个共价单键且含有两个孤电子对,所以B分子的空间构型为V形,硫化氢分子中正负电荷重心不重合,所以该分子属于极性分子,D是N2H4,D分子每个中心原子氮原子含有3个共价单键和1个孤电子对,所以N原子采用sp3杂化,
故答案为:V形;极性;sp3;
(3)C是H2O2,具有氧化性,酸性条件下,铜和双氧水发生氧化还原反应生成硫酸铜和水,铜离子与氨分子能形成铜氨配合离子,在该深蓝色的浓溶液中加入乙醇时会析出深蓝色晶体,Cu、氨水、C反应的离子方程式为,
故答案为:析出深蓝色晶体;Cu+4NH3•H2O+H2O2=[Cu(NH3)4]2++4H2O+2OH-.
点评 本题考查了物质的结构和性质,正确推断物质是解本题关键,根据核外电子排布式的书写规则、价层电子对互斥理论、等电子体的概念、均摊法计算晶胞等知识点来分析解答,易错点是第一电离能大小的判断,明确元素周期律及异常现象即可解答,难度中等.

| A. | 铍(Be)的氧化物的水化物可能具有两性 | |
| B. | 砹(At)为有色固体,HAt不稳定,AgAt感光性很强,但不溶于水也不溶于酸 | |
| C. | 硫酸锶(SrSO4)是难溶于水的白色固体 | |
| D. | 硒化氢(H2Se)是有色、有毒的气体,比H2S稳定 |
| A. | 50mL | B. | 72mL | C. | 78mL | D. | 100mL |
| A. | Na2O | B. | MgCl2 | C. | NaCl | D. | NaOH |
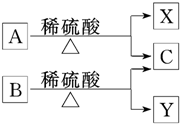 有机物A与B是分子式为C5H10O2的同分异构体,在酸性条件下均可水解,水解产物如图所示,下列有关说法中正确的是( )
有机物A与B是分子式为C5H10O2的同分异构体,在酸性条件下均可水解,水解产物如图所示,下列有关说法中正确的是( )| A. | X、Y互为同系物 | B. | C分子中的碳原子最多有3个 | ||
| C. | X、Y化学性质不可能相似 | D. | X、Y一定互为同分异构体 |
| A. | 容器内气体质量不随时间变化 | |
| B. | 容器内各物质的浓度不随时间变化 | |
| C. | 容器内混合气体的密度不随时间变化 | |
| D. | 单位时间内消耗0.1 mol X的同时生成0.2 mol Z |
| 元素符号 | X | Y | Z | R | T |
| 原子半径(nm) | 0.160 | 0.111 | 0.104 | 0.143 | 0.066 |
| 主要化合价 | +2 | +2 | -2,+4,+6 | +3 | -2 |
| A. | 离子的还原性:T2->Z2- | |
| B. | 离子半径:Z2->X2+ | |
| C. | Y的原子序数大于X | |
| D. | X和Y的最高价氧化物的水化物的碱性:Y>X |
 .
.