题目内容
19.如图示意图与对应的反应情况正确的是( )| A. |  向AgNO3和CuCl2的混合溶液中缓慢通入氨水溶液 | |
| B. |  向NaOH和Ca(OH)2的混合溶液中通入CO2 | |
| C. | 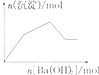 KAl(SO4)2溶液中逐滴加入Ba(OH)2溶液 | |
| D. | 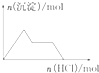 NaAlO2溶液中逐滴加入盐酸 |
分析 A.氨水过量时,氢氧化铜沉淀会溶解,图象与实际反应不相符;
B.首先生成碳酸钙白色沉淀,然后生成碳酸钠;继续通入CO2,碳酸钠和CO2反应生成碳酸氢钠,最后碳酸钙完全溶解生成碳酸氢钙;
C.铝离子和硫酸根分别和氢氧根和钡离子反应生成氢氧化铝和硫酸钡沉淀,然后形成的氢氧化铝被过量的氢氧根逐渐溶解,直到只剩余硫酸钡沉淀为止;
D.NaAlO2溶液中滴入盐酸溶液,先发生反应AlO2-+H++H2O═Al(OH)3↓生成沉淀,后发生反应Al(OH)3+3H+═Al3++3H2O,沉淀溶解至最后消失,结合前后两部分消耗盐酸溶液的体积判断.
解答 解:A.AgNO3和CuCl2的混合溶液中生成氯化银沉淀,然后缓慢通入氨水溶液中首先生成氢氧化铜沉淀,当氨水过量时生成的氢氧化铜溶解,所以图象曲线变化与实际反应不相符,故A错误;
B.向NaOH和Ca(OH)2的混合溶液中通入CO2,首先生成碳酸钙白色沉淀,然后生成碳酸钠;继续通入CO2,碳酸钠和CO2反应生成碳酸氢钠,最后碳酸钙溶解生成碳酸氢钙,图象与实际反应相符,故B正确;
C.KAl(SO4)2溶液中逐滴加入Ba(OH)2溶液,开始阶段,铝离子和硫酸根分别和氢氧根和钡离子反应生成氢氧化铝和硫酸钡沉淀,然后形成的氢氧化铝被过量的氢氧根逐渐溶解,直到只剩余硫酸钡沉淀为止,大致反应图象为: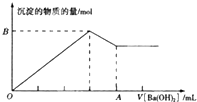 ,题中图象与实际反应不相符,故C错误;
,题中图象与实际反应不相符,故C错误;
D.NaAlO2溶液中滴入盐酸溶液,先发生AlO2-+H++H2O═Al(OH)3↓生成沉淀,后发生Al(OH)3+3H+═Al3++3H2O沉淀溶解至最后消失,反应图象为: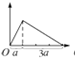 ,故D错误;
,故D错误;
故选B.
点评 本题考查离子反应的计算与图象判断,为高考的常见题型,属于中等难度的试题,解答关键是明确反应的原理,然后逐一分析,试题综合性强,旨在培养学生灵活运用基础知识解决实际问题的能力.

 双基同步导航训练系列答案
双基同步导航训练系列答案 黄冈小状元同步计算天天练系列答案
黄冈小状元同步计算天天练系列答案| A. | 氨分子的电子式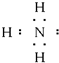 | B. | 氢氧根离子的电子式 | ||
| C. | 乙酸的结构简式 C2H4O2 | D. | 苯的实验式 C6H6 |
| 元素 | A | B | C | D |
| 性质 结构 信息 | 基态原子核外有两个电子层,最外层有3个未成对的电子 | 基态原子的M层有1对成对的p电子 | 基态原子核外电子排布为[Ar]3d104sx,有+1、+2两种常见化合价 | 有两种常见氧化物,其中有一种是冶金工业常用的还原剂 |
(2)A元素的氢化物的沸点比同主族相邻元素氢化物沸点高(填“高”或“低”),其原因氨气分子之间存在氢键.
(3)D元素最高价氧化物的熔点比同主族相邻元素最高价氧化物的熔点低(填“高”或“低”),其原因是CO2为分子晶体,SiO2是原子晶体.
(4)往C元素的硫酸盐溶液中逐滴加入过量A元素的氢化物水溶液,可生成的配合物的化学式为[Cu(NH3)4]SO4,该配合物中存在的化学键类型是ABD.(填字母)
A、离子键 B、共价键 C、金属键 D、配位键 E、分子间作用力
(5)下列分子结构图中的“●”表示上述相关元素的原子中除去最外层电子的剩余部分,“O”表示氢原子,小黑点“•”表示没有形成共价键的最外层电子,短线表示共价键.
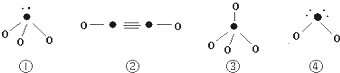
则在以上分子中,中心原子采用sp3杂化的是①③④;属于极性分子的是①④.(以上均填写序号).在②的分子中有3个σ键和2个π键.
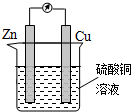
| A. | 铜片作负极 | B. | 溶液的颜色逐渐变浅 | ||
| C. | 电子由铜棒流出 | D. | 锌片上发生还原反应 |
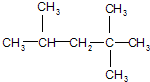 它是汽油燃烧品质抗震性能的参照物,用系统命名法对A进行命名,其名称为:2,2,4-三甲基戊烷;若A是由烯烃和H2通过加成反应得到,则该烯烃的结构简
它是汽油燃烧品质抗震性能的参照物,用系统命名法对A进行命名,其名称为:2,2,4-三甲基戊烷;若A是由烯烃和H2通过加成反应得到,则该烯烃的结构简 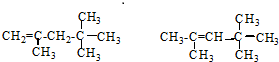 .
.