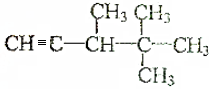
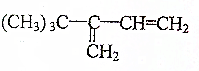
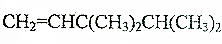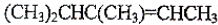题目内容
11.将10.6g Na2CO3溶于水配成多少体积的溶液,溶液浓度是0.25mol/L?分析 根据n=$\frac{m}{M}$计算碳酸钠的物质的量,再根据V=$\frac{n}{c}$计算溶液体积.
解答 解:10.6g Na2CO3的物质的量为$\frac{10.6g}{106g/mol}$=0.1mol,溶液浓度是0.25mol/L,故溶液体积为$\frac{0.1mol}{0.25mol/L}$=0.4L,即溶液体积为400mL,
答:应配成溶液体积为400mL.
点评 本题考查物质的量浓度有关计算,比较基础,注意对公式的理解与灵活应用,侧重对基础知识的巩固.

练习册系列答案
相关题目
19.如图示意图与对应的反应情况正确的是( )
| A. |  向AgNO3和CuCl2的混合溶液中缓慢通入氨水溶液 | |
| B. |  向NaOH和Ca(OH)2的混合溶液中通入CO2 | |
| C. | 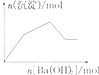 KAl(SO4)2溶液中逐滴加入Ba(OH)2溶液 | |
| D. | 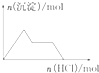 NaAlO2溶液中逐滴加入盐酸 |
6.根据下面的信息,下列叙述不正确的是( )


| A. | 化学键的断裂和行成是物质在化学反应中发生能量变化的主要原因 | |
| B. | 水分解生成氢气跟氧气的同时吸收能量 | |
| C. | 1mol H2跟$\frac{1}{2}$mol O2 反应生成1mol H2O释放能量一定为245kJ | |
| D. | 2mol H2(g)跟1mol O2 (g)反应生成2mol H2O(g)释放能量490kJ |
3.有一类组成最简单的有机硅化合物叫硅烷,它的分子组成与烷烃相似.下列有关说法中错误的是( )
| A. | 硅烷的分子通式可表示为SinH2n+2 | |
| B. | 甲硅烷燃烧生成二氧化硅和水 | |
| C. | 相同条件下甲硅烷(SiH4)的密度大于甲烷(CH4) | |
| D. | 甲硅烷的热稳定性强于甲烷 |
4.下列说法中不正确的是( )
| A. | Na2CO3比NaHCO3易溶于水 | |
| B. | Na2CO3比NaHCO3稳定 | |
| C. | 氯化钙能与Na2CO3反应,也能与NaHCO3反应 | |
| D. | 与足量盐酸反应要得到相同质量的CO2,用NaHCO3比Na2CO3的质量要少 |
 和
和 .
.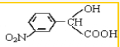 →
→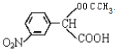 +H2O(不要求写出反应条件);用丙酮(
+H2O(不要求写出反应条件);用丙酮( 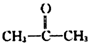 )代替化合物I发生反应②、反应③可以得到化合物Ⅵ(生产有机玻璃的中间体),化合物Ⅵ的结构简式为CH3CHOH(CH3)COOH.
)代替化合物I发生反应②、反应③可以得到化合物Ⅵ(生产有机玻璃的中间体),化合物Ⅵ的结构简式为CH3CHOH(CH3)COOH.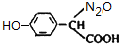 .
. 氯及其化合物在生产,生活中有着广泛的用途,回答下列问题:
氯及其化合物在生产,生活中有着广泛的用途,回答下列问题: