题目内容
利用I2O5可消除CO污染或定量测定CO,反应为:5CO(g)+I2O5(s) 5CO2(g)+I2(s);ΔH 1
5CO2(g)+I2(s);ΔH 1
(1)已知:2CO(g)+O2(g) 2CO2(g);ΔH 2
2CO2(g);ΔH 2
2I2(s)+5O2(g) 2I2O5(s);ΔH 3
2I2O5(s);ΔH 3
则ΔH 1= (用含ΔH 2和ΔH 3的代数式表示)。
(2)不同温度下,向装有足量I2O5固体的2 L恒容密闭容器中通入2molCO,测得CO2的体积分数φ(CO2)随时间t变化曲线如图。请回答:
①从反应开始至a点时的反应速率为v(CO)= ,b点时化学平衡常数Kb= 。
②d点时,温度不变,若将容器体积压缩至原来的一半,请在图中补充画出CO2体积分数的变化曲线。
③下列说法正确的是 。(填字母序号)
| A.容器内气体密度不变,表明反应达到平衡状态 |
| B.两种温度下,c点时体系中混合气体的平均相对分子质量相等 |
| C.增加I2O5的投料量有利于提高CO的转化率 |
| D.b点和d点的化学平衡常数:Kb<Kd |
(1)2.5ΔH2-0.5ΔH3(3分)
(2)①0.6mol·L-1·min-1(2分,不带单位扣1分),1024 或者45(3分)
②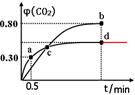
③AB(2分,选对一个得1分,有错选得0分)
(3)8.96%(3分,三位有效数字,错误扣1分)
解析试题分析:(1)根据盖斯定律,对照第1个反应和第2个反应中CO,对照第1个反应和第3个反应中I2或I2O5,可得ΔH 1=2.5ΔH2-0.5ΔH3。
(2)①设转化的CO物质的量浓度为x,根据三段式进行计算:
5CO(g)+I2O5(s) 5CO2(g)+I2(s)
5CO2(g)+I2(s)
起始浓度(mol?L?1) 1 0
转化浓度(mol?L?1) x x
平衡浓度(mol?L?1) 1-x x
a点CO2的体积分数为0.3,则x/1=0.3,可得x=0.3mol?L?1,则v(CO)=0.3mol/L÷0.5min = 0.6mol·L-1·min-1;类似a点计算,可求出b点CO的平衡浓度为0.2mol?L?1,CO2的 平衡浓度为0.8mol?L?1,则b点时化学平衡常数Kb=c5(CO2)÷c5(CO)=0.85÷0.25=45。
②d点时,温度不变,若将容器体积压缩至原来的一半,压强增大,因为该反应前后气体的系数相等,所以增大压强,平衡不移动,CO2的体积分数不变,可画出CO2体积分数的变化曲线。
③A、容器内气体密度不变,说明气体的质量不变,则反应达到平衡状态,正确;B、c点时两温度下CO2的体积分数相等,说明气体组成相同,则体系中混合气体的平均相对分子质量相等,正确;C、因为I2O5为固体,增加I2O5的投料量,CO的转化率不变,错误;D、b点CO2的体积分数大,说明b点平衡常数大,所以Kb > Kd,错误。
(3)根据化学方程式可得对应关系:5CO ~ I2~2Na2S2O3,n(CO)=5/2n(Na2S2O3)=5/2×0.0100mol·L-1×0.02L×4=0.002mol,则样品气中CO的体积分数为:0.002mol×22.4L/mol÷0.5L×100%=8.96%
考点:本题考查盖斯定律、化学反应速率的计算、化学平衡的判断和计算、体积分数的计算。

 全能测控一本好卷系列答案
全能测控一本好卷系列答案氨氧化制硝酸的反应如下(未配平):①NH3 + O2 →NO + H2O ②NO + O2 → NO2
③NO2+H2O→HNO3+NO,如将氨全部氧化得2mol硝酸,理论上需氧气的物质的量是( )
| A.2mol | B.3 mol | C.4 mol | D.5 mol |
过氧化钙晶体[CaO2·8H2O]较稳定,呈白色,微溶于水,能溶于酸性溶液。广泛应用于环境杀菌、消毒等领域。
★过氧化钙晶体的制备
工业上生产CaO2·8H2O的主要流程如下: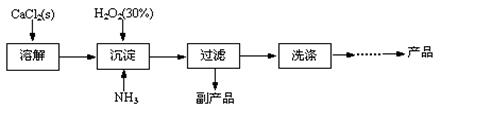
(1)用上述方法制取CaO2·8H2O的化学方程式是 。
(2)沉淀时常用冰水控制温度在10℃以下和通入过量的NH3,其可能原因分别是
① ;② 。
★过氧化钙晶体含量的测定
准确称取0.3000g产品于锥形瓶中,加入30 mL蒸馏水和10 mL 2.000 mol·L-1 H2SO4,用0.0200mol·L—1 KMnO4标准溶液滴定至终点。重复上述操作两次。H2O2和KMnO4反应的离子方程式为2MnO4-+5 H2O2+6H+=2Mn2++5O2↑+8H2O
(3)滴定终点观察到的现象为 。
(4)根据表1数据计算产品中CaO2·8H2O的质量分数(写出计算过程):
| 滴定次数 | 样品的质量/g | KMnO4溶液的体积/mL | |
| 滴定前刻度/mL | 滴定后刻度/mL | ||
| 1 | 0.3000 | 1.02 | 24.04 |
| 2 | 0.3000 | 2.00 | 25.03 |
| 3 | 0.3000 | 0.20 | 23.24 |
表1. KMnO4标准溶液滴定数据
近年来地质、环境灾难频频发生,为防止在大灾之后疫病流行,灾区需要大量的各种消毒剂、漂白剂等。
(1)二氧化氯是目前国际上公认的第四代高效、无毒的广谱消毒剂,它可由KClO3与SO2在H2SO4作用下反应制得。请写出反应的离子方程式: 。
(2)过碳酸钠是一种新型固态漂白剂,化学式可表示为Na2CO3·3H2O2,它具有Na2CO3和H2O2的双重性质。过碳酸钠与下列物质均会发生化学反应而失效,其中过碳酸钠只发生了氧化反应的是 。
| A.MnO2 | B.KMnO4溶液 | C.稀盐酸 | D.Na2SO3溶液 |
 CuSO4+A↑+2H2O
CuSO4+A↑+2H2O
 Cu+____CuCl2+N2↑+____H2O。
Cu+____CuCl2+N2↑+____H2O。 。
。 Cr2O72-(橙色)+H2O。
Cr2O72-(橙色)+H2O。 Cr3+(aq)+3OH-(aq),常温下,Cr(OH)3的溶度积Ksp=10-32,当c(Cr3+)降至10-5 mol·L-1时,认为c(Cr3+)已经完全沉淀,现将第③步溶液的pH调至4,请通过计算说明Cr3+是否沉淀完全(请写出计算过程):____________________________________________________________________________。
Cr3+(aq)+3OH-(aq),常温下,Cr(OH)3的溶度积Ksp=10-32,当c(Cr3+)降至10-5 mol·L-1时,认为c(Cr3+)已经完全沉淀,现将第③步溶液的pH调至4,请通过计算说明Cr3+是否沉淀完全(请写出计算过程):____________________________________________________________________________。