题目内容
【题目】根据要求回答问题:
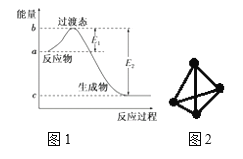
(1)图1是1 mol NO2(g)和1 mol CO(g)反应生成CO2和NO过程中的能量变化示意图,若在反应体系中加入催化剂,反应速率增大,E1的变化是________(填“增大”、“减小”或“不变”,下同),ΔH的变化是________。
(2)已知CH3OH(l)的燃烧热为726.5kJ·mol-1,CH3OH(l)+ 1/2O2(g)═CO2(g)+2H2(g)△H= -a kJ·mol-1 ,则a________726.5(填“>”、“<”或“=”)。
(3)科学家已获得了极具理论研究意义的N4分子,其结构为正四面体(如图2所示),与白磷分子相似。已知断裂1mol N-N键吸收193 kJ热量,断裂1 mol N≡N键吸收941 kJ热量,则1 mol N4气体转化为2 mol N2时的△H= ________。
(4)在微生物作用的条件下,NH4+经过两步反应被氧化成NO3-。这两步的能量变化如图:
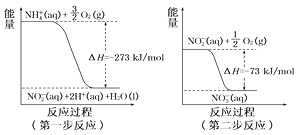
第二步反应是________反应(填“放热”或“吸热”)。1 mol NH4+(aq)全部氧化成NO3-(aq)的热化学方程式是_____________。
【答案】减小 不变 < 724kJmol1 放热 ![]()
【解析】
(1)催化剂能降低反应所需的活化能,但催化剂不能改变反应物的总能量和生成物的总能量之差,据此分析;
(2)写出甲醇和氢气燃烧的热化学方程式,与题给的热化学方程式联立,然后根据盖斯定律,即可做出判断;
(3)本小题要注意一个N4分子中含有6个N-N键,要乘以6;
(4)根据盖斯定律和热化学方程式的书写要求作答;
(1)加入催化剂能降低反应所需的活化能,则E1和E2都减小,催化剂不能改变反应物的总能量和生成物的总能量之差,即反应热不改变,所以催化剂对反应热无影响;
故答案为:减小;不变;
(2)①![]()
②![]()
③![]()
根据盖斯定律,①=②+③,即![]() =
=![]() +
+![]() ,因为
,因为![]() 、
、![]() 、
、![]() 均小于0,所以a<726.5
均小于0,所以a<726.5
故答案为:<;
(3) 从结构图中可看出,一个N4分子中含有6个N-N键,根据反应热等于反应物的总键能减生成物的总键能,则N4(g)=2N2(g)的△H=6×193kJmol-1-2×941kJmol-1=-724 kJmol-1,
故答案为:724kJmol1;
(4)由图可知,第二步反应的焓变小于0,所以第二步反应为放热反应;第一步的热化学方程式为![]() ,第二步的热化学方程式为:
,第二步的热化学方程式为:![]() ,根据盖斯定律则
,根据盖斯定律则![]() ,
,
故答案为:![]() ;
;

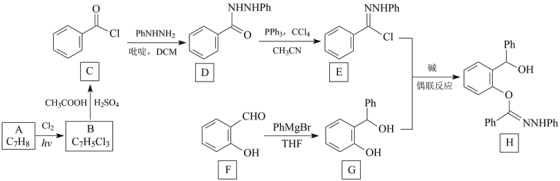
【题目】腈亚胺与邻酚羟基苄醇在碱的作用下可以发生偶联反应生成醚键,反应的条件温和,操作简单,目标产物收率高。下面是利用该方法合成化合物H的一种方法:
注:以上合成路线中,Ph代表苯基,如PhNHNH2表示![]() 。
。
实验 | 碱 | 温度/℃ | 溶剂 | 产率% |
1 | Et3N | 25 | DCM | <10 |
2 | 吡啶 | 25 | DCM | <5 |
3 | Cs2CO3 | 25 | DCM | 70 |
4 | LiOtBu | 25 | DCM | 43 |
5 | Cs2CO3 | 25 | DMF | 79 |
6 | Cs2CO3 | 25 | CH3CN | 83 |
回答下列问题:
(1)A的化学名称为_________,B的结构简式为___________。
(2)由C生成D的反应类型是________,F中的官能团名称是___________。
(3)H的分子式为_______________。
(4)不同条件对偶联反应生成H产率的影响如上表:
观察上表可知,当选用DCM作溶剂时,最适宜的碱是____________,由实验3、实验4和实验5可得出的结论是:25℃时,____________________,H产率最高。
(5)X为G的同分异构体,写出满足下列条件的X的结构简式:____________。
①所含苯环个数与G相同;②有四种不同化学环境的氢,其个数比为1:1:2:2
(6)利用偶联反应,以![]() 和化合物D为原料制备
和化合物D为原料制备 ,
,
写出合成路线:____________________________。(其他试剂任选)