题目内容
若锌与稀硝酸反应时,其化学反应方程式为
 ,则a、b、c、M可能分别为( )
,则a、b、c、M可能分别为( )
 ,则a、b、c、M可能分别为( )
,则a、b、c、M可能分别为( )| A.4、1、5、N2O | B.4、2、4、NO2 |
| C.4、1、3、NH4NO3 | D.4、3、5、NO |
AC
试题分析:根据方程式可知,锌的化合价从0价升高到+2价,失去2个电子。根据原子守恒可知a=4,则被还原的硝酸最多是2mol,如果2mol全部被还原,则根据得失得失守恒可知氮原子得到4个电子,所以其还原产物中的化合价是+1价,即还原产物是N2O,A正确;如果2mol硝酸只有1mol被还原,则氮原子得到8个电子,其还原产物中的氮元素的化合价是-3价,则还原产物是硝酸铵,C正确,答案选AC。
点评:该题是高考中的常见题型,属于中等难度的试题。试题贴近高考,综合性强,在注重对学生基础知识巩固与训练的同时,侧重对学生能力的培养与解题方法的指导和训练,旨在考查学生灵活运用基础知识解决实际问题的能力,有利于培养学生的逻辑推理能力和发散思维能力。该题的关键是利用好电子的得失守恒,然后讨论、分析、判断即可。

练习册系列答案
相关题目
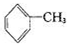 +6KMnO4+9H2SO4=3K2SO4+6MnSO4+14H2O+_______。
+6KMnO4+9H2SO4=3K2SO4+6MnSO4+14H2O+_______。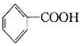
 MnCl2 + C12↑ + 2H2O。下列说法不正确的是( )
MnCl2 + C12↑ + 2H2O。下列说法不正确的是( )  K2S+N2↑+3a 已配平
K2S+N2↑+3a 已配平