题目内容
【题目】现有部分元素的原子结构特点如表,下列叙述中正确的是( )
X | L层电子数是K层电子数的3倍 |
Y | 核外电子层数等于原子序数 |
Z | L层电子数是K层和M层电子数之和 |
W | 共用三对电子形成双原子分子,常温下为气体单质 |
A.W原子结构示意图为![]()
B.元素X和Y只能形成原子个数比为1∶2的化合物
C.元素X比元素Z的非金属性强
D.X、Y、Z、W四种元素不能形成离子化合物
【答案】C
【解析】
X元素原子的L层电子数是K层电子数的3倍,可知L层为6个电子,所以X为氧元素;Y元素原子的核外电子层数等于原子序数,Y只能是H元素;Z 元素原子的L层电子数是K层和M层电子数之和,其M层电子数为6,所以Z是S元素;W元素原子共用三对电子形成双原子分子,常温下为气体单质,所以W为N元素,据此分析解答。
根据上述分析,X为氧元素,Y是H元素,Z是S元素,W为N元素。
A.W为N元素,原子核外有2个电子层,最外层电子数为5,原子结构示意图为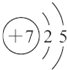 ,故A错误;
,故A错误;
B.元素X和元素Y可以以原子个数比1∶1形成化合物,为H2O2,故B错误;
C.X为O,Z为S,位于同一主族,非金属性O>S,故C正确;
D.X、Y、Z、W四种元素可以形成离子化合物(NH4)2SO4或NH4HSO4等,故D错误;
故选C。

 走进文言文系列答案
走进文言文系列答案【题目】现有 8 种元素的性质、数据如下表所列,它们属于第二或第三周期。
① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |
原子半径(10-10m) | 0.74 | 1.60 | 1.52 | 1.10 | 0.99 | 1.86 | 0.75 | 0.82 |
最高或最低化合价 | +2 | +1 | +5 | +7 | +1 | +5 | +3 | |
-2 | -3 | -1 | -3 |
回答下列问题:
(1)④的元素名称是_____,⑧的元素符号是_____。②在元素周期表中的位置是(周期、族)_____ 。
(2)在最高价氧化物的水化物中,酸性最强的化合物的分子式是_____;名称是________; 碱性最强的化合物的电子式是:_________; 属_____化合物(填“离子”或“共价”)。
(3)①的最简单氢化物的电子式为_____, ⑦的最简单氢化物的电子式为_____,结构式为_____。
(4)写出⑦的最高价氧化物对应水化物跟它的氢化物反应的化学方程式:_________________ 。
(5)写出②最高价氧化物对应水化物跟⑤的氢化物水溶液反应的离子方程式:____________。