题目内容
【题目】氯仿(CHCl3)不溶于水,但在一定条件下水解生成两种酸,其中一种是甲酸(HCOOH)。在19世纪氯仿广泛用于麻醉,可由“乙醛漂白粉法”制得。在光照条件下,氯仿易被空气氧化生成剧毒光气(COCl2)和一种化合物。因此氯仿需要小口钢罐贮存运输,使用前要检验其是否变质。
(1)CHCl3的电子式为__________,HCOOH中C的杂化方式为__________;
(2)漂白粉中三种元素的简单离子的半径的大小顺序为__________(用离子符号表示);
(3)氯仿不溶于水而甲酸易溶于水的原因是__________;
(4)Fe2+的外围电子排布图为__________;
(5)纯铁的一种同素异形体的晶胞为面心立方晶胞,该晶体中原子的配位数为__________,若铁原子的半径为a cm,则该晶体的密度为__________。
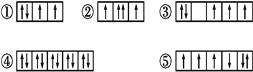
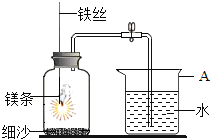
【答案】 三角形 sp2 Cl->Ca2+>O2- 甲酸分子与水分子间形成氢键 ![]() 12
12 ![]() g/cm3或
g/cm3或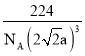 g/cm3
g/cm3
【解析】(1).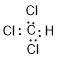 ,Cl原子与H原子一样,与C原子共用一对电子;
,Cl原子与H原子一样,与C原子共用一对电子;
(2).漂白粉的主要成分为Ca(ClO)2,半径排序为:Ca2+,Cl-核外电子数均为18,但Ca2+核内质子数大于Cl-元素,所以Ca2+半径小,O2-核外电子为两层,半径最小,半径排序为:Cl->Ca2+>O2-;
(3).氯仿分子的极性较弱,而水为极性分子,两者极性相差较大而不相溶;甲酸中含有羟基,易与水分子形成氢键,所以易溶于水;
(4). Fe2+原子核外有24个电子,其3d轨道上6个电子为其外围电子,排布式为3d6,由于电子总是优先单独占据一个轨道,故外围电子排布图为![]() ;
;
(5).面心立方最密堆积方式配位数为12,每个晶胞中含有4个原子,晶胞的每个侧面对角线长为4r,边长为:2 ![]() 所以该晶体密度为:
所以该晶体密度为: 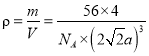 g/cm;
g/cm;

【题目】甲醇是一种重要的有机化工原料。
(1)已知:
①C2H4(g)+H2O(g)→C2H5OH(g) ΔH1=-45.5 kJ/mol
②2CH3OH(g)→CH3OCH3(g)+H2O(g) ΔH2=-23.9 kJ/mol
③C2H5OH(g)→CH3OCH3(g) ΔH3=+50.7 kJ/mol
请写出乙烯和水蒸气化合生成甲醇气体的热化学方程式:__________。
(2)合成甲醇的反应为:CO(g)+2H2(g) ![]() CH3OH(g) ΔH。相同条件下,向容积相同的a、b、c、d、e五个密闭容器中分别充入等量的物质的量之比为1:2的CO和H2的混合气体,改变温度进行实验,测得反应进行到t min时甲醇的体积分数如图甲所示。
CH3OH(g) ΔH。相同条件下,向容积相同的a、b、c、d、e五个密闭容器中分别充入等量的物质的量之比为1:2的CO和H2的混合气体,改变温度进行实验,测得反应进行到t min时甲醇的体积分数如图甲所示。
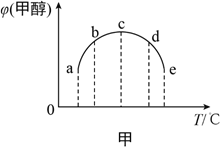
①温度升高甲醇的体积分数增大的原因是__________.
②根据图像判断ΔH__________(填“>”、“<”或“=”)0。
(3)为了研究甲醇转化为二甲醚的反应条件,某研究与小组在三个体积均为1.0 L的恒容密闭容器中发生反应:2CH3OH(g) ![]() CH3OCH3(g)+H2O(g) ΔH2=-23.9 kJ/mol。
CH3OCH3(g)+H2O(g) ΔH2=-23.9 kJ/mol。
容器编号 | 温度/℃ | 起始物质的量/mol | 平衡物质的量/mol | |
CH3OH(g) | CH3OCH3(g) | H2O(g) | ||
Ⅰ | T1 | 0.20 | 0.080 | 0.080 |
Ⅱ | T1 | 0.40 | A | a |
Ⅲ | T2 | 0.20 | 0.090 | 0.090 |
①T1温度下该反应的平衡常数K=__________;反应温度T1__________T2(填“大于”或“小于”。)
②容器Ⅱ中a=__________。
③下列说法能说明反应达到平衡状态的是__________(填字母)。
A.容器中气体压强不再变化
B.用CH3OH和CH3OCH3表示的反应速率之比为2:1
C.混合气体的密度不变
D.容器内CH3OH和CH3OCH3的浓度之比为2:1
E.混合气体中c(CH3OCH3)不变