题目内容
(10分)100 mL 2 mol/L的稀硝酸与1.92 g铜充分反应后:
(1)产生的气体是________,在标准状况下的体积为________L,反应过程中转移的电子数为________mol。
(2)若溶液的体积不变,则反应后溶液中的H+物质的量浓度为________mol/L,NO3-物质的量浓度为________mol/L。
(1)产生的气体是________,在标准状况下的体积为________L,反应过程中转移的电子数为________mol。
(2)若溶液的体积不变,则反应后溶液中的H+物质的量浓度为________mol/L,NO3-物质的量浓度为________mol/L。
(10分)
(1)NO;0.448;0.06;(2)1.2;1.8 (各2分)
(1)NO;0.448;0.06;(2)1.2;1.8 (各2分)
(1)根据硝酸的氧化性规律,浓硝酸一般生成 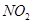 ,稀硝酸一般生成
,稀硝酸一般生成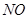 ,100 mL 2 mol/L的稀硝酸中硝酸的物质的量为0.1ⅹ2="0.2" mol,1.92 g铜的物质的量为1.92/64="0.03" mol根据反应方程式计算如下:
,100 mL 2 mol/L的稀硝酸中硝酸的物质的量为0.1ⅹ2="0.2" mol,1.92 g铜的物质的量为1.92/64="0.03" mol根据反应方程式计算如下:
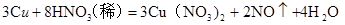
3 8 2
0.03mol 0. 2mol 0.02 mol
根据反应课判断稀硝酸过量,所以生成的气体应按照铜的量进行计算,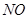 的物质的量为0.02 mol ,标准状况下的体积为0.02ⅹ22.4=0.448L,反应过程中硝酸中的氮元素从+5价降低到一氧化氮中的+2价,降低3个所以转移的电子用
的物质的量为0.02 mol ,标准状况下的体积为0.02ⅹ22.4=0.448L,反应过程中硝酸中的氮元素从+5价降低到一氧化氮中的+2价,降低3个所以转移的电子用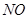 的量进行计算为
的量进行计算为
0.02ⅹ3=0.06mol
(2)根据反应可以判断参加反应的硝酸的物质的量为0.08 mol剩余的硝酸的物质的量为0.2-0.08="0.12" mol,则H+物质的量浓度为0.12/0.1=1.2mol/L,根据氮守恒反应完全后溶液中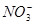 的物质的量为0.2-0.02=0.18mol,所以
的物质的量为0.2-0.02=0.18mol,所以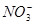 的物质的量浓度为0.18/0.1="1.8" mol/L.
的物质的量浓度为0.18/0.1="1.8" mol/L.
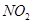 ,稀硝酸一般生成
,稀硝酸一般生成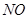 ,100 mL 2 mol/L的稀硝酸中硝酸的物质的量为0.1ⅹ2="0.2" mol,1.92 g铜的物质的量为1.92/64="0.03" mol根据反应方程式计算如下:
,100 mL 2 mol/L的稀硝酸中硝酸的物质的量为0.1ⅹ2="0.2" mol,1.92 g铜的物质的量为1.92/64="0.03" mol根据反应方程式计算如下: 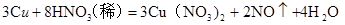
3 8 2
0.03mol 0. 2mol 0.02 mol
根据反应课判断稀硝酸过量,所以生成的气体应按照铜的量进行计算,
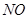 的物质的量为0.02 mol ,标准状况下的体积为0.02ⅹ22.4=0.448L,反应过程中硝酸中的氮元素从+5价降低到一氧化氮中的+2价,降低3个所以转移的电子用
的物质的量为0.02 mol ,标准状况下的体积为0.02ⅹ22.4=0.448L,反应过程中硝酸中的氮元素从+5价降低到一氧化氮中的+2价,降低3个所以转移的电子用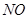 的量进行计算为
的量进行计算为0.02ⅹ3=0.06mol
(2)根据反应可以判断参加反应的硝酸的物质的量为0.08 mol剩余的硝酸的物质的量为0.2-0.08="0.12" mol,则H+物质的量浓度为0.12/0.1=1.2mol/L,根据氮守恒反应完全后溶液中
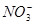 的物质的量为0.2-0.02=0.18mol,所以
的物质的量为0.2-0.02=0.18mol,所以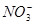 的物质的量浓度为0.18/0.1="1.8" mol/L.
的物质的量浓度为0.18/0.1="1.8" mol/L.
练习册系列答案
相关题目

 2NH3,该反应在固定容积的密闭容器中进行。
2NH3,该反应在固定容积的密闭容器中进行。



