题目内容
(14分)工业上以氨气为原料(铂铑合金网为催化剂)催化氧化法制硝酸的过程如下:

(1)已知反应一经发生,铂铑合金网就会处于红热状态。写出氨催化氧化的化学方程式 。当温度升高时,化学平衡常数K值 (填“增大”、“减小”、“无影响”)。
(2)硝酸厂尾气常用的处理方法是:催化还原法:催化剂存在时用H2将NO2还原为N2。
已知:2H2(g)+O2(g)=2H2O(g)△H=-483.6 kJ/mol
N2(g)+2O2(g)=2NO2(g) △H=+67.7 kJ/mol
H2O(1)=H2O(g) △H=+44.0 kJ/mol
则8g H2恰好将NO2转化成N2和H2O(1)时△H= 。
(3)氨气是制取硝酸的重要原料,合成氨反应的化学方程式如下:N2+3H2 2NH3,该反应在固定容积的密闭容器中进行。
2NH3,该反应在固定容积的密闭容器中进行。
①下列各项标志着该反应达到化学平衡状态的是 (填字母)。
②若在恒温条件下,将N2与H2按一定比例混合通入一个容积为2 L固定容积的密闭容器中,5 min后反应达平衡时,n(N2)=1.2 mol,n(H2)=1.2 mol, n(NH3)=0.8 mol,则反应速率v(N2)= ,平衡常数= (保留两位小数)。若保持容器的温度和容积不变,将上述平衡体系中的混合气体的浓度增大1倍,则平衡 (填向左、向右或不移动)移动。

(1)已知反应一经发生,铂铑合金网就会处于红热状态。写出氨催化氧化的化学方程式 。当温度升高时,化学平衡常数K值 (填“增大”、“减小”、“无影响”)。
(2)硝酸厂尾气常用的处理方法是:催化还原法:催化剂存在时用H2将NO2还原为N2。
已知:2H2(g)+O2(g)=2H2O(g)△H=-483.6 kJ/mol
N2(g)+2O2(g)=2NO2(g) △H=+67.7 kJ/mol
H2O(1)=H2O(g) △H=+44.0 kJ/mol
则8g H2恰好将NO2转化成N2和H2O(1)时△H= 。
(3)氨气是制取硝酸的重要原料,合成氨反应的化学方程式如下:N2+3H2
 2NH3,该反应在固定容积的密闭容器中进行。
2NH3,该反应在固定容积的密闭容器中进行。①下列各项标志着该反应达到化学平衡状态的是 (填字母)。
| A.容器内N2、H2、NH3的浓度之比为l:3:2 |
B. |
| C.容器内压强保持不变 |
| D.混合气体的密度保持不变 |
(1)4NH3+5O2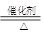 4NO+6H2O (2分)减小(2分)(2)-1210.9 kJ/mol(2分)
4NO+6H2O (2分)减小(2分)(2)-1210.9 kJ/mol(2分)
(3)①BC(2分)②0.04mol·L-1·min-1(2分) 1.23(2分)向右(2分)
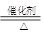 4NO+6H2O (2分)减小(2分)(2)-1210.9 kJ/mol(2分)
4NO+6H2O (2分)减小(2分)(2)-1210.9 kJ/mol(2分)(3)①BC(2分)②0.04mol·L-1·min-1(2分) 1.23(2分)向右(2分)
本题考查化学反应中的能量变化和化学反应速率和化学平衡的有关计算。
(1)已知反应一经发生,铂铑合金网就会处于红热状态。写出氨催化氧化的化学方程式4NH3+5O2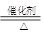 4NO+6H2O,由于事成氨反应是放热反应,温度升高平衡向逆反应方向进行,平衡常数值减小。
4NO+6H2O,由于事成氨反应是放热反应,温度升高平衡向逆反应方向进行,平衡常数值减小。
(2)用H2将NO2还原为N2的方程式为2NO2(g)+4H2(g)= N2(g)+4H2O(l),由已知反应2H2(g)+O2(g)=2H2O(g)△H=-483.6 kJ/mol①N2(g)+2O2(g)=2NO2(g)△H=+67.7 kJ/mol②H2O(1)=H2O(g)△H=+44.0 kJ/mol③,根据盖斯定律,2×①-②-4×③可得2NO2(g)+4H2(g)= N2(g)+4H2O;△H=-1210.9kJ/mol,即8g H2恰好将NO2转化成N2和H2O(1)时△H=-1210.9kJ/mol。
(3)①判断达到平衡的标志是“会改变的量不变了,就达到了平衡状态”。故A、D不合题意,由于反应容器的体积不变,故反应前后混合气体的密度保持不变,即不会改变的量。
② 先计算V(NH3)=(0.8 mol/2L)/5min=0.08mol·L-1·min-1,由速率之比等于计量数之比可知,V(N2)= V(NH3)/2=0.04mol·L-1·min-1。平衡时各物质的浓度分别为c(N2)= 1.2 mol/2L="0.6" mol/L、c(H2)= 1.2 mol/2L="0.6" mol/L、c(NH3)= 0.8 mol/2L=0.4mol/L,则K= c2(NH3)/[ c(N2) ·c3(H2)]= 0.42/(0.6·错误!链接无效。3)= 1.23。若保持容器的温度和容积不变,将上述平衡体系中的混合气体的浓度增大1倍,则Q== c2(NH3)/[ c(N2) ·c3(H2)]= 0.82/(1.2·1.23)= 0.38<K,则平衡向右移动。
(1)已知反应一经发生,铂铑合金网就会处于红热状态。写出氨催化氧化的化学方程式4NH3+5O2
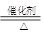 4NO+6H2O,由于事成氨反应是放热反应,温度升高平衡向逆反应方向进行,平衡常数值减小。
4NO+6H2O,由于事成氨反应是放热反应,温度升高平衡向逆反应方向进行,平衡常数值减小。(2)用H2将NO2还原为N2的方程式为2NO2(g)+4H2(g)= N2(g)+4H2O(l),由已知反应2H2(g)+O2(g)=2H2O(g)△H=-483.6 kJ/mol①N2(g)+2O2(g)=2NO2(g)△H=+67.7 kJ/mol②H2O(1)=H2O(g)△H=+44.0 kJ/mol③,根据盖斯定律,2×①-②-4×③可得2NO2(g)+4H2(g)= N2(g)+4H2O;△H=-1210.9kJ/mol,即8g H2恰好将NO2转化成N2和H2O(1)时△H=-1210.9kJ/mol。
(3)①判断达到平衡的标志是“会改变的量不变了,就达到了平衡状态”。故A、D不合题意,由于反应容器的体积不变,故反应前后混合气体的密度保持不变,即不会改变的量。
② 先计算V(NH3)=(0.8 mol/2L)/5min=0.08mol·L-1·min-1,由速率之比等于计量数之比可知,V(N2)= V(NH3)/2=0.04mol·L-1·min-1。平衡时各物质的浓度分别为c(N2)= 1.2 mol/2L="0.6" mol/L、c(H2)= 1.2 mol/2L="0.6" mol/L、c(NH3)= 0.8 mol/2L=0.4mol/L,则K= c2(NH3)/[ c(N2) ·c3(H2)]= 0.42/(0.6·错误!链接无效。3)= 1.23。若保持容器的温度和容积不变,将上述平衡体系中的混合气体的浓度增大1倍,则Q== c2(NH3)/[ c(N2) ·c3(H2)]= 0.82/(1.2·1.23)= 0.38<K,则平衡向右移动。

练习册系列答案
 小学教材全测系列答案
小学教材全测系列答案 小学数学口算题卡脱口而出系列答案
小学数学口算题卡脱口而出系列答案
相关题目
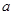 L含硫酸铵、硝酸铵的混合溶液分成两等份,一份用
L含硫酸铵、硝酸铵的混合溶液分成两等份,一份用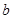 mol烧碱刚好把NH3全部赶出,另一份与氯化钡溶液完全反应消耗
mol烧碱刚好把NH3全部赶出,另一份与氯化钡溶液完全反应消耗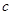 molBaCl2,则原溶液中
molBaCl2,则原溶液中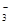 )为( )
)为( )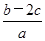 mol·L-1
mol·L-1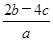 mol·1-1
mol·1-1 mol·L-1
mol·L-1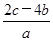 mol·L-1
mol·L-1 g HNO3被还原成NO,n:m可能
g HNO3被还原成NO,n:m可能