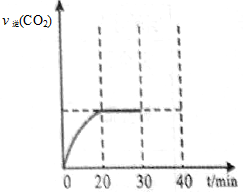
题目内容
重晶石(BaSO4)是重要的化工原料,制备氢氧化钡晶体[Ba(OH)2·8H2O]的流程如下:

(1)写出煅烧时发生反应的热化学方程式:____________________________。
(2)写出氢氧化钡晶体与氯化铵晶体混合反应的化学方程式:_____________________。
(3)为检测煅烧时产生的CO,可将煅烧产生的气体通入PbCl2溶液中,出现黑色沉淀和产生一种无色无味能使澄清石灰水变浑浊的气体,试写出该反应的化学方程式:_____。
(4)向BaSO4沉淀中加入饱和Na2CO3溶液,充分搅拌,弃去上层清液,如此处理多次,可使BaSO4全部转化为BaCO3。发生的反应可表示为:
BaSO4(s)+CO32-(aq) BaCO3(s)+SO42-(aq)
BaCO3(s)+SO42-(aq)
现有0.20 mol BaSO4,加入1.0L 2.0mol?L-1饱和Na2CO3溶液处理,假设c(SO42-)起始≈0
平衡时,K=4.0x10-2,求反应达到平衡时发生转化的BaSO4的物质的量。(写出计算过程结果保留2位有效数字)
(5)试从平衡的角度解释BaSO4可转化为BaCO3的原因:________________________。

(1)写出煅烧时发生反应的热化学方程式:____________________________。
(2)写出氢氧化钡晶体与氯化铵晶体混合反应的化学方程式:_____________________。
(3)为检测煅烧时产生的CO,可将煅烧产生的气体通入PbCl2溶液中,出现黑色沉淀和产生一种无色无味能使澄清石灰水变浑浊的气体,试写出该反应的化学方程式:_____。
(4)向BaSO4沉淀中加入饱和Na2CO3溶液,充分搅拌,弃去上层清液,如此处理多次,可使BaSO4全部转化为BaCO3。发生的反应可表示为:
BaSO4(s)+CO32-(aq)
 BaCO3(s)+SO42-(aq)
BaCO3(s)+SO42-(aq)现有0.20 mol BaSO4,加入1.0L 2.0mol?L-1饱和Na2CO3溶液处理,假设c(SO42-)起始≈0
平衡时,K=4.0x10-2,求反应达到平衡时发生转化的BaSO4的物质的量。(写出计算过程结果保留2位有效数字)
(5)试从平衡的角度解释BaSO4可转化为BaCO3的原因:________________________。
(17分)
(1)BaSO4(s) + 4C(s)="BaS(s)" + 4CO(g) △H="+571.2" kJ?mol-1
(4分,其中:方程式2分,ΔH 2分,错漏单位扣1分,状态错漏0分。其他计量数,合理即给分)
(2)Ba(OH)2·8H2O +2NH4Cl=BaCl2+2NH3↑+10 H2O (2分,写Ba(OH)2反应给0分)
(3)CO +PbCl2+H2O=Pb↓+CO2↑+2HCl (2分)
(4)设发生转化的BaSO4的物质的量为xmol,则平衡时c(SO42-)为x mol?L-1(1分)
BaSO4(s)+CO32- BaCO3(s)+SO42-
BaCO3(s)+SO42-
起始浓度(mol?L-1): 2.0 0
转化浓度(mol?L-1): x x
平衡浓度(mol?L-1): (2.0—x) x (1分)
K= =
= =4.0×10-2 (2分,其中列式、代入数值各1分)
=4.0×10-2 (2分,其中列式、代入数值各1分)
x = 7.7×10-2 (2分,单位、有效数字错漏合扣1分)
答:发生转化的BaSO4的物质的量为7.7×10-2 mol
(5)BaSO4沉淀中存在沉淀溶解平衡:BaSO4(s) Ba2+(aq) + SO42-(aq) (1分),加入饱和碳酸钠溶液,CO32-浓度增大,使Qc(BaCO3)=c(Ba2+)×c(CO32-)>Ksp(BaCO3) ,形成碳酸钡的过饱和溶液,因此析出BaCO3沉淀(1分),c(Ba2+)减小,使BaSO4沉淀向溶解方向移动,BaSO4转化为BaCO3(1分)。(合理即给分)
Ba2+(aq) + SO42-(aq) (1分),加入饱和碳酸钠溶液,CO32-浓度增大,使Qc(BaCO3)=c(Ba2+)×c(CO32-)>Ksp(BaCO3) ,形成碳酸钡的过饱和溶液,因此析出BaCO3沉淀(1分),c(Ba2+)减小,使BaSO4沉淀向溶解方向移动,BaSO4转化为BaCO3(1分)。(合理即给分)
(1)BaSO4(s) + 4C(s)="BaS(s)" + 4CO(g) △H="+571.2" kJ?mol-1
(4分,其中:方程式2分,ΔH 2分,错漏单位扣1分,状态错漏0分。其他计量数,合理即给分)
(2)Ba(OH)2·8H2O +2NH4Cl=BaCl2+2NH3↑+10 H2O (2分,写Ba(OH)2反应给0分)
(3)CO +PbCl2+H2O=Pb↓+CO2↑+2HCl (2分)
(4)设发生转化的BaSO4的物质的量为xmol,则平衡时c(SO42-)为x mol?L-1(1分)
BaSO4(s)+CO32-
 BaCO3(s)+SO42-
BaCO3(s)+SO42-起始浓度(mol?L-1): 2.0 0
转化浓度(mol?L-1): x x
平衡浓度(mol?L-1): (2.0—x) x (1分)
K=
 =
= =4.0×10-2 (2分,其中列式、代入数值各1分)
=4.0×10-2 (2分,其中列式、代入数值各1分)x = 7.7×10-2 (2分,单位、有效数字错漏合扣1分)
答:发生转化的BaSO4的物质的量为7.7×10-2 mol
(5)BaSO4沉淀中存在沉淀溶解平衡:BaSO4(s)
 Ba2+(aq) + SO42-(aq) (1分),加入饱和碳酸钠溶液,CO32-浓度增大,使Qc(BaCO3)=c(Ba2+)×c(CO32-)>Ksp(BaCO3) ,形成碳酸钡的过饱和溶液,因此析出BaCO3沉淀(1分),c(Ba2+)减小,使BaSO4沉淀向溶解方向移动,BaSO4转化为BaCO3(1分)。(合理即给分)
Ba2+(aq) + SO42-(aq) (1分),加入饱和碳酸钠溶液,CO32-浓度增大,使Qc(BaCO3)=c(Ba2+)×c(CO32-)>Ksp(BaCO3) ,形成碳酸钡的过饱和溶液,因此析出BaCO3沉淀(1分),c(Ba2+)减小,使BaSO4沉淀向溶解方向移动,BaSO4转化为BaCO3(1分)。(合理即给分)试题分析:(1)硫酸钡与焦碳在高温下发生氧化还原反应,生成硫化钡和一氧化碳,硫元素由+6降为—2价,碳元素由0升为+2价,根据化合价升降总数相等配平,则该反应为;BaSO4(s)+4C(s)=BaS(s)+4CO(g);将已知反应编号为①②③,观察发现,②×2+③—①可得重晶石与焦碳的反应式,根据盖斯定律,BaSO4(s)+4C(s)=BaS(s)+4CO(g)的焓变=②的焓变×2+③的焓变—①的焓变=[—221×2—460—(—1473.2)]kJ/mol=+571.2 kJ/mol;(2)铵盐与强碱能发生复分解反应,生成盐、氨气和水,由此推断:Ba(OH)2·8H2O +2NH4Cl=BaCl2+2NH3↑+10 H2O;依题意,一氧化碳被氧化成二氧化碳,碳元素由+2升为+4价,则CO是还原剂,由此推断氯化铅是氧化剂,被还原为黑色的单质铅,根据化合价升降总数相等配平,该反应为CO +PbCl2+H2O=Pb↓+CO2↑+2HCl;(4)设发生转化的BaSO4的物质的量为xmol,则平衡时c(SO42-)为x mol?L-1(1分)
BaSO4(s)+CO32-
 BaCO3(s)+SO42-
BaCO3(s)+SO42-起始浓度(mol?L-1): 2.0 0
转化浓度(mol?L-1): x x
平衡浓度(mol?L-1): (2.0-x) x (1分)
K=
 =
=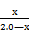 =4.0×10-2 (2分,其中列式、代入数值各1分)
=4.0×10-2 (2分,其中列式、代入数值各1分)x = 7.7×10-2 (2分,单位、有效数字错漏合扣1分)
答:发生转化的BaSO4的物质的量为7.7×10-2 mol。
(5)BaSO4沉淀中存在沉淀溶解平衡:BaSO4(s)
 Ba2+(aq) + SO42-(aq),加入饱和碳酸钠溶液能增大CO32-浓度,使Qc(BaCO3)=c(Ba2+)×c(CO32-)>Ksp(BaCO3) ,形成碳酸钡的过饱和溶液,因此析出BaCO3沉淀,造成c(Ba2+)减小,使BaSO4沉淀向溶解方向移动,BaSO4转化为BaCO3。
Ba2+(aq) + SO42-(aq),加入饱和碳酸钠溶液能增大CO32-浓度,使Qc(BaCO3)=c(Ba2+)×c(CO32-)>Ksp(BaCO3) ,形成碳酸钡的过饱和溶液,因此析出BaCO3沉淀,造成c(Ba2+)减小,使BaSO4沉淀向溶解方向移动,BaSO4转化为BaCO3。
练习册系列答案
相关题目
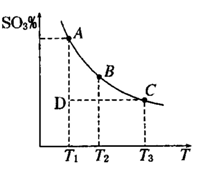
 2SO3(g),混合体系中SO3 的百分含量和温度的关系如下图所示(曲线上任何一点都表示平衡状态).根据图示回答下列问题,
2SO3(g),混合体系中SO3 的百分含量和温度的关系如下图所示(曲线上任何一点都表示平衡状态).根据图示回答下列问题,
 (填“>”“<”或“=”)
(填“>”“<”或“=”)

 CH3OH(g) △H=QkJ/mol
CH3OH(g) △H=QkJ/mol ( CH3OH)与反应温度T的关系曲线如图2所示,则上述反应的Q_____0(填“>”“<”或“=”);
( CH3OH)与反应温度T的关系曲线如图2所示,则上述反应的Q_____0(填“>”“<”或“=”); 2Fe(s)+3CO2(g) △H= -28.5 kJ·(mol-1
2Fe(s)+3CO2(g) △H= -28.5 kJ·(mol-1 2CO(g) △H=" +" 172.5 kJ·mol-1
2CO(g) △H=" +" 172.5 kJ·mol-1
 2SO3(g) ?H=-196.6 kJ·mol-1
2SO3(g) ?H=-196.6 kJ·mol-1 2NO2(g) ?H=-113.0 kJ·mol-1
2NO2(g) ?H=-113.0 kJ·mol-1 

 2Fe(s)+3CO2(g),请回答下列问题:
2Fe(s)+3CO2(g),请回答下列问题: CH3CH2OH(g) + H2O(g) △H =" —256.1" kJ·mol-1
CH3CH2OH(g) + H2O(g) △H =" —256.1" kJ·mol-1