题目内容
研究碳及其化合物的综合利用对促进低碳社会的构建具有重要的意义。
(1)高温时,用CO还原MgSO4可制备高纯MgO。
①750℃时,测得气体中含等物质的量SO2和SO3,此时反应的化学方程式是 _____;
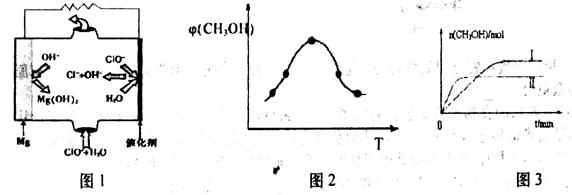
②由MgO可制成“镁——次氯酸盐”电池,其装置示意图如图1,该电池正极的电极反应式为_________;
(2)二氧化碳合成甲醇是碳减排的新方向,将CO2转化为甲醇的热化学方程式为:
CO2(g)+3H2(g) CH3OH(g) △H=QkJ/mol
CH3OH(g) △H=QkJ/mol
①该反应的平衡常数表达式为K=_______。
②取五份等体积CO2和H2的混合气体(物质的量之比均为1:3),分别加入温度不同、容积相同的恒容密闭容器中发生上述反应,反应相同时间后测得甲醇的体积分数 ( CH3OH)与反应温度T的关系曲线如图2所示,则上述反应的Q_____0(填“>”“<”或“=”);
( CH3OH)与反应温度T的关系曲线如图2所示,则上述反应的Q_____0(填“>”“<”或“=”);
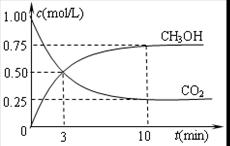
③在其中两个容器中,测得CH3OH的物质的量随时间变化如图3所示,曲线I、II对应的平衡常数大小关系为K1_________K11(填“>”“<”或“=”)。
(3)用H2或CO催化还原NO可以达到消除污染的目的。
已知:2NO(g)=N2(g)+O2(g) △H=-180.5kJ/mol
2H2O(l)=2H2(g)+O2(g) △H=+571.6kJ/mol
则H2(g)与NO(g)反应生成N2(g)和H2O(l)的热化学方程式是________。
(1)高温时,用CO还原MgSO4可制备高纯MgO。
①750℃时,测得气体中含等物质的量SO2和SO3,此时反应的化学方程式是 _____;
②由MgO可制成“镁——次氯酸盐”电池,其装置示意图如图1,该电池正极的电极反应式为_________;

(2)二氧化碳合成甲醇是碳减排的新方向,将CO2转化为甲醇的热化学方程式为:
CO2(g)+3H2(g)
 CH3OH(g) △H=QkJ/mol
CH3OH(g) △H=QkJ/mol①该反应的平衡常数表达式为K=_______。
②取五份等体积CO2和H2的混合气体(物质的量之比均为1:3),分别加入温度不同、容积相同的恒容密闭容器中发生上述反应,反应相同时间后测得甲醇的体积分数
 ( CH3OH)与反应温度T的关系曲线如图2所示,则上述反应的Q_____0(填“>”“<”或“=”);
( CH3OH)与反应温度T的关系曲线如图2所示,则上述反应的Q_____0(填“>”“<”或“=”);③在其中两个容器中,测得CH3OH的物质的量随时间变化如图3所示,曲线I、II对应的平衡常数大小关系为K1_________K11(填“>”“<”或“=”)。
(3)用H2或CO催化还原NO可以达到消除污染的目的。
已知:2NO(g)=N2(g)+O2(g) △H=-180.5kJ/mol
2H2O(l)=2H2(g)+O2(g) △H=+571.6kJ/mol
则H2(g)与NO(g)反应生成N2(g)和H2O(l)的热化学方程式是________。
(共14分)(1)①CO+2MgSO4 2MgO+CO2+SO2+SO3(3分)
2MgO+CO2+SO2+SO3(3分)
②ClO-+2e-+H2O=Cl-+2OH-(2分) (2)①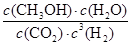 (2分) ②<(2分) >(2分)
(2分) ②<(2分) >(2分)
(3)2H2(g)+2NO(g)=N2(g)+2H2O(l) △H==-752.1kJ/mol(3分)
 2MgO+CO2+SO2+SO3(3分)
2MgO+CO2+SO2+SO3(3分)②ClO-+2e-+H2O=Cl-+2OH-(2分) (2)①
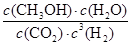 (2分) ②<(2分) >(2分)
(2分) ②<(2分) >(2分) (3)2H2(g)+2NO(g)=N2(g)+2H2O(l) △H==-752.1kJ/mol(3分)
试题分析:(1)①用CO还原MgSO4可得到MgO、CO2、SO2和SO3,且测得气体中含等物质的量SO2和SO3,所以此时反应的化学方程式是CO+2MgSO4
 2MgO+CO2+SO2+SO3。
2MgO+CO2+SO2+SO3。②原电池中负极失去电子,发生氧化反应。正极得到电子,发生还原反应。根据装置图可知“镁-次氯酸盐”燃料电池中Mg是活泼的金属,做负极。正极是ClO-得到电子发生还原反应,所以该电池反应的总反应方程式为Mg+ClO-+H2O=Cl-+Mg(OH)2,因此正极电极反应为ClO-+2e-+H2O=Cl-+2OH-。
(2)①化学平衡常数是在一定条件下,当可逆反应达到平衡状态时,生成物浓度的幂之积和反应物浓度的幂之积的比值,所以根据反应的化学方程式可知,该反应的平衡常数K=
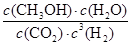 。
。②根据图2可知,最高点反应到达平衡状态。达平衡后,温度越高,甲醇的体积分数
 ( CH3OH)越小,这说明升高温度平衡向逆反应方向进行。升高温度平衡向吸热方向进行,即逆反应为吸热反应,则正反应为放热反应,即△H<0。
( CH3OH)越小,这说明升高温度平衡向逆反应方向进行。升高温度平衡向吸热方向进行,即逆反应为吸热反应,则正反应为放热反应,即△H<0。③根据图3可知,曲线为T2时反应首先达到平衡状态,温度高反应速率快,所以温度T1<T2。正反应是放热反应,因此升高温度平衡向吸热反应移动,所以KⅠ>KⅡ。
(3)根据反应①2NO(g)=N2(g)+O2(g) △H=-180.5kJ/mol和反应②2H2O(l)=2H2(g)+O2(g) △H=+571.6kJ/mol,并依据盖斯定律可知,①-②即得到反应2H2(g)+2NO(g)=N2(g)+2H2O(l),所以该反应的反应热△H=-180.5kJ/mol-571.6kJ/mol=-752.1kJ/mol。

练习册系列答案
相关题目
 SO3(g)+NO(g)将体积比为1∶2的NO2、SO2气体置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是 。
SO3(g)+NO(g)将体积比为1∶2的NO2、SO2气体置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是 。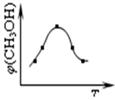
 CH3OH(g);△H=-90.8kJ·mol-1
CH3OH(g);△H=-90.8kJ·mol-1 CH3OCH3(g)+H2O(g)某温度下的平衡常数为400。
CH3OCH3(g)+H2O(g)某温度下的平衡常数为400。 _______
_______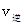 (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。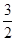 O2(g)=HNO2(aq)+H+(aq)+H2O(1) ΔH="-b" KJ/mol
O2(g)=HNO2(aq)+H+(aq)+H2O(1) ΔH="-b" KJ/mol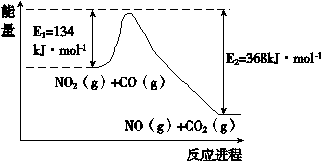
 2NH3 (g) ΔH<0,
2NH3 (g) ΔH<0,

 CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)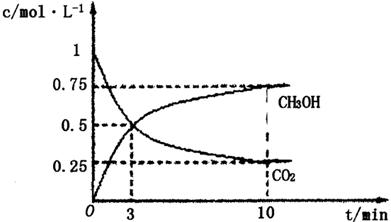
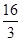 (mol/L)-2
(mol/L)-2

 BaCO3(s)+SO42-(aq)
BaCO3(s)+SO42-(aq)