题目内容
图a是1 mol NO2和1 mol CO反应生成CO2和NO过程中能量变化示意图,图b是反应中的CO和NO的浓度随时间变化的示意图。根据图意回答下列问题:


a b
(1)写出NO2和CO反应的热化学方程式 。
(2)从反应开始到平衡,用NO2浓度变化表示平均反应速率v(NO2)= 。
(3)此温度下该反应的平衡常数K= ;温度降低,K (填“变大”、“变小”或“不变”)
(4)若在温度和容积相同的三个密闭容器中,按不同方式投入反应物,测得反应达到平衡吋的有关数据如下表:
则:α1+α2= , a+b/2= ,m=


a b
(1)写出NO2和CO反应的热化学方程式 。
(2)从反应开始到平衡,用NO2浓度变化表示平均反应速率v(NO2)= 。
(3)此温度下该反应的平衡常数K= ;温度降低,K (填“变大”、“变小”或“不变”)
(4)若在温度和容积相同的三个密闭容器中,按不同方式投入反应物,测得反应达到平衡吋的有关数据如下表:
| 容 器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 1 mol NO2 1 mol CO | 2 mol NO 2 mol CO2 | 1 mol NO2、1 mol CO 1 mol NO、1 mol CO2 |
| 平衡时c(NO) /mol·L-1 | 1.5 | 3 | m |
| 能量变化 | 放出a kJ | 吸收b kJ | 放出c kJ |
| CO或NO的转化率 | α1 | α2 | α3 |
(1)NO2(g)+CO(g)=NO(g)+CO2(g) ΔH=—234 kJ/mol
(2)1.50/t1 mol·L-1·min-1 (3) 9 ; 变大 (4) 1 ; 234 ; 3
(2)1.50/t1 mol·L-1·min-1 (3) 9 ; 变大 (4) 1 ; 234 ; 3
试题分析:(1)根据图像a可知,反应物的总能量高于生成物的总能量,反应是放热反应,△H=134 kJ/mol-368kJ/mol=-234 kJ/mol,则该反应的热化学方程式是NO2(g)+CO(g)=NO(g)+CO2(g) ΔH=—234 kJ/mol。
(2)根据图像b可知,平衡时NO的浓度是1.50mol/L,则消耗NO2的浓度是1.50mol/L,所以从反应开始到平衡,用NO2浓度变化表示平均反应速率v(NO2)=1.50mol/L÷t1=1.50/t1 mol·L-1·min-1。
(3)根据图像b可知,平衡时NO2、CO、NO和CO2的浓度分别是(mol/L)0.5、0.5、1.5、1.5,则根据方程式可知,该反应的平衡常数K=
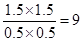 。正方应是放热反应,温度降低,平衡向正反应方向移动,则平衡常数增大。
。正方应是放热反应,温度降低,平衡向正反应方向移动,则平衡常数增大。(4)因为该反应是体积不变的可逆反应,三个容器中反应物的起始量之比是相同的,所以平衡是等效的。甲和乙两个容器的反应方向相反,则α1+α2=1;a=234 kJ/mol×0.75mol,b=234 kJ/mol×0.5mol,则a+b/2=234kJ。由于丙中的平衡也是等效的,则m=3mol/L。
点评:该题是高考中的常见题型,属于中等难度的试题。有利于培养学生的逻辑推理能力和发散思维能力。该题的难点是等效平衡的判断和应用,所谓等效平衡是指外界条件相同时,同一可逆反应只要起始浓度相当,无论经过何种途径,都可以达到相同的平衡状态。等效平衡的判断及处理一般步骤是:进行等效转化——边倒法,即按照反应方程式的计量数之比转化到同一边的量,与题干所给起始投料情况比较。

练习册系列答案
相关题目
 O2(g)=HNO2(aq)+H+(aq)+H2O(1) ΔH="-b" KJ/mol
O2(g)=HNO2(aq)+H+(aq)+H2O(1) ΔH="-b" KJ/mol
 BaCO3(s)+SO42-(aq)
BaCO3(s)+SO42-(aq)

 2SO3(g) 在一定条件下达到平衡,测得c(SO3)=0.040mol/L。则该条件下反应的平衡常数K的数值为___________,SO2的平衡转化率为__________。
2SO3(g) 在一定条件下达到平衡,测得c(SO3)=0.040mol/L。则该条件下反应的平衡常数K的数值为___________,SO2的平衡转化率为__________。

 O2(g)=H2O(l) ΔH3= ─285.8 kJ?mol-1
O2(g)=H2O(l) ΔH3= ─285.8 kJ?mol-1