题目内容
乙醇汽油是被广泛使用的新型清洁燃料,工业生产乙醇的一种反应原理为:
2CO(g) + 4H2(g) CH3CH2OH(g) + H2O(g) △H =" —256.1" kJ·mol-1
CH3CH2OH(g) + H2O(g) △H =" —256.1" kJ·mol-1
已知:CO(g) + H2O(g) CO2(g)+H2(g) △H=" —41.2" kJ·mol-1
CO2(g)+H2(g) △H=" —41.2" kJ·mol-1
(1)以CO2(g)与H2(g)为原料也可合成乙醇,其热化学方程式如下:
2CO2(g) +6H2(g) CH3CH2OH(g) +3H2O(g) △H = 。
CH3CH2OH(g) +3H2O(g) △H = 。
(2)汽车使用乙醇汽油并不能减少NOx的排放,这使NOx的有效消除成为环保领域的重要课题。
①某研究小组在实验室以Ag– ZSM– 5为催化剂,测得NO转化为N2的转化率随温度变化情况如下图。若不使用CO,温度超过800℃,发现NO的转化率降低,其可能的原因为 ;在n(NO)/n(C O)=1的条件下,应控制的最佳温度在 左右。

②用活性炭还原法处理氮氧化物。有关反应为:C (s) +2NO2(g) N2 (g) + CO2 (g)。某研究小组向某密闭容器中加人足量的活性炭和NO,恒温( T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
N2 (g) + CO2 (g)。某研究小组向某密闭容器中加人足量的活性炭和NO,恒温( T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
I.根据表中数据,求反应开始至20min以v(NO)表示的反应速率为 (保留两位有效数字),T1℃时该反应的平衡常数为 (保留两位有效数字)。
II.30min后,改变某一条件,反应重新达到平衡,则改变的条件可能是 。下图表示CO2的逆反应速率[v逆(CO2)]随反应时间的变化关系图。请在图中画出在30min改变上述条件时,在40min时刻再次达到平衡的变化曲线。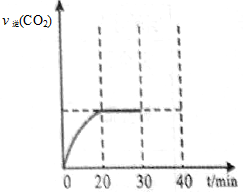
2CO(g) + 4H2(g)
 CH3CH2OH(g) + H2O(g) △H =" —256.1" kJ·mol-1
CH3CH2OH(g) + H2O(g) △H =" —256.1" kJ·mol-1已知:CO(g) + H2O(g)
 CO2(g)+H2(g) △H=" —41.2" kJ·mol-1
CO2(g)+H2(g) △H=" —41.2" kJ·mol-1(1)以CO2(g)与H2(g)为原料也可合成乙醇,其热化学方程式如下:
2CO2(g) +6H2(g)
 CH3CH2OH(g) +3H2O(g) △H = 。
CH3CH2OH(g) +3H2O(g) △H = 。(2)汽车使用乙醇汽油并不能减少NOx的排放,这使NOx的有效消除成为环保领域的重要课题。
①某研究小组在实验室以Ag– ZSM– 5为催化剂,测得NO转化为N2的转化率随温度变化情况如下图。若不使用CO,温度超过800℃,发现NO的转化率降低,其可能的原因为 ;在n(NO)/n(C O)=1的条件下,应控制的最佳温度在 左右。

②用活性炭还原法处理氮氧化物。有关反应为:C (s) +2NO2(g)
 N2 (g) + CO2 (g)。某研究小组向某密闭容器中加人足量的活性炭和NO,恒温( T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
N2 (g) + CO2 (g)。某研究小组向某密闭容器中加人足量的活性炭和NO,恒温( T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:| 浓度/mol?L-1 时间/min | NO | N2 | CO2 |
| 0 | 1.00 | 0 | 0 |
| 20 | 0.40 | 0.30 | 0.30 |
| 30 | 0.40 | 0.30 | 0.30 |
| 40 | 0.32 | 0.34 | 0.17 |
| 50 | 0.32 | 0.34 | 0.17 |
I.根据表中数据,求反应开始至20min以v(NO)表示的反应速率为 (保留两位有效数字),T1℃时该反应的平衡常数为 (保留两位有效数字)。
II.30min后,改变某一条件,反应重新达到平衡,则改变的条件可能是 。下图表示CO2的逆反应速率[v逆(CO2)]随反应时间的变化关系图。请在图中画出在30min改变上述条件时,在40min时刻再次达到平衡的变化曲线。

(17分)
(1)—173.7kJ?mol-1(3分)
(2)①该反应是放热反应,升高温度反应更有利于向逆反应方向进行(2分)
900℃(2分)
②I.0.030mol?L-1?mol-1(3分,没写单位扣1分)
0.56(3分)
II.减小CO2的浓度(2分)
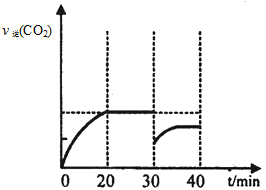 (2分)
(2分)
作图要点:起点在30min时v逆(CO2)的一半以下;终点不超过30min时v逆(CO2)
(1)—173.7kJ?mol-1(3分)
(2)①该反应是放热反应,升高温度反应更有利于向逆反应方向进行(2分)
900℃(2分)
②I.0.030mol?L-1?mol-1(3分,没写单位扣1分)
0.56(3分)
II.减小CO2的浓度(2分)
 (2分)
(2分)作图要点:起点在30min时v逆(CO2)的一半以下;终点不超过30min时v逆(CO2)
试题分析:(1)将题目中出现的三个热化学方程式依次编号为①②③,观察可得①—②×2=③,根据盖斯定律可知,③的焓变=①的焓变—②的焓变×2=—173.7kJ?mol-1;(2)①若不使用CO,则反应为2NO(g)
 N2(g)+O2(g),随着温度的升高,反应速率增大,从开始反应到达到平衡时,NO转化为N2的转化率随温度升高而逐渐增大,达到平衡后,再升高温度,NO的转化率随温度升高逐渐减小,说明正反应是放热反应,升高温度使平衡左移;有CO时,发生的不可逆反应为CO+NO
N2(g)+O2(g),随着温度的升高,反应速率增大,从开始反应到达到平衡时,NO转化为N2的转化率随温度升高而逐渐增大,达到平衡后,再升高温度,NO的转化率随温度升高逐渐减小,说明正反应是放热反应,升高温度使平衡左移;有CO时,发生的不可逆反应为CO+NO N2+CO2,NO的转化率随温度的升高而逐渐增大,但是900℃→1000℃时NO的转化率增大程度不大,但是生产成本却会明显增加,因此在n(NO)/n(C O)=1的条件下,应控制的最佳温度为900℃;②I.读表中信息可得,从反应开始到20min,NO的变化浓度=(1.00—0.40) mol?L-1=0.60 mol?L-1,根据平均反应速率的定义式可知,v(NO)=△c/△t=0.030mol?L-1?mol-1;由于固体物质浓度是常数,不需要写入平衡常数表达式,读表中信息可知,20min时该反应在T1℃时达到平衡,则K=[c(CO2)?c(N2)]/c2(NO2)=[0.30×0.30]/0.402≈0.56;II.30min改变条件后,根据三行数据法可知:
N2+CO2,NO的转化率随温度的升高而逐渐增大,但是900℃→1000℃时NO的转化率增大程度不大,但是生产成本却会明显增加,因此在n(NO)/n(C O)=1的条件下,应控制的最佳温度为900℃;②I.读表中信息可得,从反应开始到20min,NO的变化浓度=(1.00—0.40) mol?L-1=0.60 mol?L-1,根据平均反应速率的定义式可知,v(NO)=△c/△t=0.030mol?L-1?mol-1;由于固体物质浓度是常数,不需要写入平衡常数表达式,读表中信息可知,20min时该反应在T1℃时达到平衡,则K=[c(CO2)?c(N2)]/c2(NO2)=[0.30×0.30]/0.402≈0.56;II.30min改变条件后,根据三行数据法可知:C (s) +2NO2(g)
 N2 (g) + CO2 (g)
N2 (g) + CO2 (g)起始浓度/mol?L-1 0.40 0.30 0.30
变化浓度/mol?L-1 0.080 0.040 0.040
平衡浓度/mol?L-1 0.32 0.34 0.34(2分)
由于二氧化碳的理论浓度比实际浓度大0.17mol/L,说明30min时从原平衡体系中移出了CO2,减小CO2的浓度;由于30min时生成物CO2的浓度减少了一半,则v逆(CO2)立即减少一半,所以起点的横坐标为30min、纵坐标为原平衡的一半;减小生成物浓度,平衡向正反应方向移动,则v逆(CO2)逐渐增大,直到40min才达到新的平衡,但是此时CO2的浓度比原平衡时小,因此v逆(CO2)比原平衡时小, 所以终点的横坐标为40min、纵坐标比原平衡的一半大,但是比原平衡时小。

练习册系列答案
 新思维假期作业寒假吉林大学出版社系列答案
新思维假期作业寒假吉林大学出版社系列答案
相关题目
 CH3OH(g);△H=-90.8kJ·mol-1
CH3OH(g);△H=-90.8kJ·mol-1 CH3OCH3(g)+H2O(g)某温度下的平衡常数为400。
CH3OCH3(g)+H2O(g)某温度下的平衡常数为400。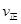 _______
_______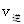 (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。


 BaCO3(s)+SO42-(aq)
BaCO3(s)+SO42-(aq) 2Fe(s)+3CO2(g) △H
2Fe(s)+3CO2(g) △H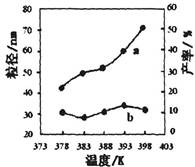


 2SO3(g) 在一定条件下达到平衡,测得c(SO3)=0.040mol/L。则该条件下反应的平衡常数K的数值为___________,SO2的平衡转化率为__________。
2SO3(g) 在一定条件下达到平衡,测得c(SO3)=0.040mol/L。则该条件下反应的平衡常数K的数值为___________,SO2的平衡转化率为__________。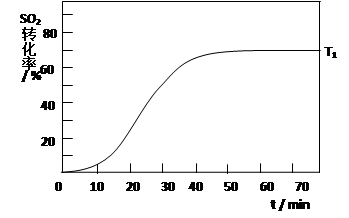
 2HCl(g);△H=-184.6kJ·mol-1,
2HCl(g);△H=-184.6kJ·mol-1,