题目内容
【题目】两份质量相等的Na2O2和NaHCO3混合物,其中一份加入足量的盐酸充分反应后放出2.24L(标准状况)的气体;将这些气体通入另一份混合物中使其充分反应,气体体积变为2.016L(标准状况).则原混合物中Na2O2和NaHCO3的物质的量之比为
A.8:1B.2:1C.3:2D.2:9
【答案】AD
【解析】
第一份发生反应为:2Na2O2+4HCl=4NaCl+2H2O+O2↑、NaHCO3+HCl=NaCl+H2O+CO2↑,生成气体2.24L为O2、CO2,将第一份生成的气体,通入第二份Na2O2的NaHCO3的混合粉末,发生反应:2Na2O2+2CO2=2Na2CO3+O2,导致气体体积减小,讨论二氧化碳是否过量,结合方程式计算过氧化钠、碳酸氢钠的物质的量,据此进行解答
:
2.24L混合气体的物质的量为:![]() =0.1mol,
=0.1mol,
2.016L气体的物质的量为:![]() =0.09mol,
=0.09mol,
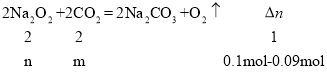
则n=m=0.02mol,
若CO2完全反应,则第一份生成CO2的物质的量为0.02mol,O2的物质的量为:0.1mol0.02mol=0.08mol,
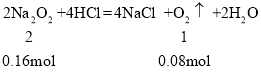
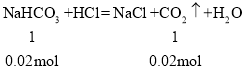
所以Na2O2为0.16mol,NaHCO3为0.02mol,则原混合物中Na2O2和NaHCO3的物质的量之比为0.16mol:0.02mol=8:1;
若CO2有剩余,则Na2O2的物质的量为:0.02mol,
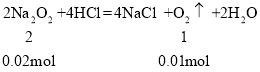
则第一份生成O2的为0.01mol,所以CO2的物质的量为:0.1mol0.01mol=0.09mol,

所以Na2O2为0.02mol,NaHCO3为0.09mol,则原混合物中Na2O2和NaHCO3的物质的量之比为0.02mol:0.09mol=2:9,
故答案为:AD。

练习册系列答案
 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案
相关题目