题目内容
【题目】已知水在25℃和95℃时,其电离平衡曲线如右图所示:
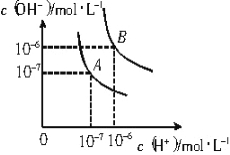
(1)则25℃时水的电离平衡曲线应为 (填“A”或“B”),请说明理由 。
(2)95℃时,若10体积pH1= a的某强酸溶液与1体积pH2= b的某强碱溶液混合后溶液呈中性,则混合前,该强酸的pH1与强碱的pH2之间应满足的关系是__________________。
(3)25℃时,将pH = 11的NaOH溶液与pH = 4的H2SO4溶液混合,若所得混合溶液的pH = 10,则NaOH溶液与H2SO4溶液的体积比为__________________。
(4)曲线B对应温度下,pH = 2的某HA溶液和pH = 10的NaOH溶液等体积混合后,混合溶液的pH = 5。请分析其原因: 。
【答案】(1)A (2分) 水的电离是吸热过程,温度低,电离程度小,c(H+)、c(OH-)小 (2分)
(2)a+b=13或pH1+pH2=13(2分)(3)2:9(2分)
(4)曲线B对应95℃,此时水的离子积为10-12,HA为弱酸,HA和NaOH中和后,混合溶液中还剩余较多的HA分子,可继续电离出H+,使溶液pH=5(2分)
【解析】
试题分析:
(1)水的电离是吸热过程,升高温度,使水的电离程度增大,当温度升高时,促进水的电离,水的离子积增大,水中氢离子、氢氧根离子浓度都增大,则曲线A为25℃时的电离平衡曲线;
(2)要注意的是95°C时,水的离子积为10-12,即酸、碱浓度相等时pH(酸)+pH(碱)=12,现强碱的OH-浓度是强酸H+浓度的10倍,所以pH(酸)+pH(碱)=13,即pH1+pH2=13,或a+b=13;
(3)25℃时,pH = 11的NaOH溶液中c(OH-)碱=10-3mol/L,pH = 4的H2SO4溶液中c(H+)酸=10-4mol/L,所得混合溶液的pH = 10,说明酸、碱混合时碱过量溶液呈碱性,混合溶液中c(OH-)混=10-4mol/L,设酸的体积为V(H2SO4),碱的体积为V(NaOH),则有:c(OH-)混×[V(H2SO4)+V(NaOH)]=c(OH-)碱×V(NaOH)-c(H+)酸×V(H2SO4),求解可得:V(NaOH):V(H2SO4)=2:9;
(4)曲线B对应95℃,pH=2的某酸HA中氢离子浓度与pH=10的NaOH溶液中氢氧根离子浓度相等,HA若为强酸,完全反应后pH=6,实际上pH=5,说明酸过量,则该酸为弱酸,HA中和NaOH后,混合溶液中还剩余较多的HA分子,可继续电离出H+,导致溶液中氢离子浓度大于氢氧根离子浓度而使溶液呈酸性;故答案为:曲线B对应95℃,此时水的离子积为10-12,HA若为强酸,最后应为pH=6,现pH=5,说明HA为弱酸,HA中和NaOH后,混合溶液中还剩余较多的HA分子,可继续电离出H+。