题目内容
【题目】下列叙述正确的是
A. NH4+、Al3+、Cl-、HCO3-在溶液中能大量共存
B. H2O2的电子式是:![]()
C. AlCl3溶液中加入过量的氨水:Al3++3NH3·H2O=Al(OH)3↓+3NH4+
D. 铁锈是化合物,可用Fe2O3·nH2O(2<n<3)表示
【答案】C
【解析】A. Al3+与HCO3-在溶液中能发生双水解反应,生成氢氧化铝沉淀和二氧化碳,不能大量共存,故A错误;B. H2O2少于共价化合物,电子式是![]() ,故B错误; C. AlCl3溶液中加入过量的氨水生成氢氧化铝沉淀和氯化铵,离子方程式为Al3++3NH3·H2O=Al(OH)3↓+3NH4+,故C正确;D. 铁锈属于混合物,故D错误;故选C。
,故B错误; C. AlCl3溶液中加入过量的氨水生成氢氧化铝沉淀和氯化铵,离子方程式为Al3++3NH3·H2O=Al(OH)3↓+3NH4+,故C正确;D. 铁锈属于混合物,故D错误;故选C。

 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案【题目】通过对煤的综合利用可得到洁净的燃料和多种化工原料,也可减少环境呢污染。煤的间接液化可得到甲醇。
(1)已知:CH3OH、H2的燃烧热(△H)分别为-726.5kJ/mol、-285.8kJ/mol,则常温下CO2和H2反应生成CH3OH和H2O的热化学方程式是____________。
(2)一定条件下,CO和H2合成CH3OH:CO(g)+2H2(g)![]() CH3OH(g)。
CH3OH(g)。
①在体积一定的密闭容器中按物质的量之比1:2充入CO和H2,测得平衡混合物中CH3OH的体积分数在不同压强下随温度的变化如图所示。
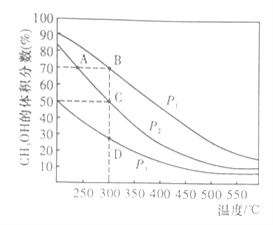
A、B、C三点平衡常数KA、KB、KC的大小关系是___________;压强:P1____P2(填“>”、“<”或“=”)
逆反应速率:v逆(A)______v逆(B)(填“>”、“<”或“=”)
在C点,CO的转化率为__________;
在C点,若再按物质的量之比1:2充入一定量的CO和H2,当其它条件不变,达到新的平衡时,CH3OH的体积分数__________(填“增大”、“减小”或“不变”)。
②若在恒温恒容条件下,能表示该可逆反应达到平衡状态的有__________。
A. 混合气体的密度保持不变
B. 混合气体的平均相对分子质量保持不变
C. 容器内的压强保持不变
D. 单位时间内每消耗1molCO的同时,生成2molH2
E. CO、H2、CH3OH的浓度保持不变
F. CO、H2、CH3OH的浓度之比为1:2:1
(3)氢硫酸、碳酸均为二元弱酸,其常温下的电离常数如下表:
H2CO3 | H2S | |
Ka1 | 4.4×10-7 | 1.3×10-7 |
Ka2 | 4.7×10-11 | 7.1×10-15 |
煤的气化过程中产生的有害气体H2S可用足量的Na2CO3溶液吸收,该反应的离子方程式为________;常温下,0.1mol·L-1NaHCO3溶液和0.1mol·L-1NaHS溶液的pH相比,pH较小的为______溶液(填化学式)。