��Ŀ����
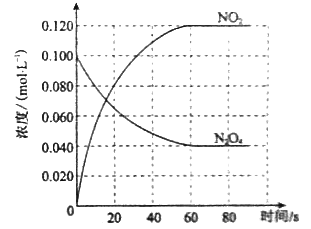
����Ŀ����2014�¿α�2�����ݻ�Ϊ1.00L�������У�ͨ��һ������N2O4��������ӦN2O4(g)![]() 2NO2(g)�����¶����ߣ�����������ɫ���
2NO2(g)�����¶����ߣ�����������ɫ���
�ش��������⣺
��1����Ӧ����H 0����������������С��������100��ʱ����ϵ�и�����Ũ����ʱ��仯����ͼ��ʾ����0~60sʱ�Σ���Ӧ����v(N2O4)Ϊ molL-1s-1����Ӧ��ƽ�ⳣ��K1Ϊ ��
��2��100��ʱ�ﵽƽ��ı䷴Ӧ�¶�ΪT��c(N2O4)��0.0020 molL-1s-1��ƽ�����ʽ��ͣ���10s�ִﵽƽ�⡣
a��T 100��������������������������������� ��
b����ʽ�����¶�Tʱ��Ӧ��ƽ�ⳣ��K2 ��
��3���¶�Tʱ��Ӧ��ƽ�����Ӧ�������ݻ�����һ�룬ƽ���� ����������Ӧ�������淴Ӧ���������ƶ����ж������� ��
���𰸡�
��1������ 0.001 0.36 mol��L��1��
��2��a�����ڣ�
��Ӧ���������ȣ���Ӧ�����ȷ�����У����¶�����
b��ƽ��ʱ��c��NO2��=0.120 mol��L��1+0.002 mol��L��1��s��1��10s��2=0.160mol��L��1
c��N2O4��=0.040 mol��L��1��0.002 mol��L��1��s��1��10s=0.02 mol��L��1
K2= ��0.160mol��L��1��2/0.020mol��L��1=1.3mol��L��1
��3���淴Ӧ ���������������ķ�Ӧ������ѹǿƽ�����淴Ӧ�����ƶ�
������������Ľ���Ҫ��Ϊ����Ϥ��ѧ��Ӧ���ʡ���ѧƽ�ⳣ���ĸ����ؼ��㹫ʽ��������������Ի�ѧ��Ӧ���ʺͻ�ѧƽ���Ӱ����ɡ�����ʱһ��Ҫ�������⣬��������ṩ��������Ϣ�����ݣ�ȷ�������ͼ��������Ϣ��ץס��c(N2O4)��0.0020 molL-1s-1��ƽ�����ʽ������ȹؼ����ۣ�ȷ������ص���ѧ������
��1�����������Ϸ�ӦN2O4(g)![]() 2NO2(g)֪�����¶����ߣ�����������ɫ��������������Ũ������˵��ƽ��������Ӧ�����ƶ��������¶ȶԻ�ѧƽ���Ӱ����ɣ�����������������ʱ�������¶ȣ�ƽ�������ȷ�Ӧ�����ƶ���֪���÷�Ӧ����Ӧ����Ϊ���ȷ�Ӧ����H����0���������ͼ��֪��0����60sʱ�Σ�N2O4�����ʵ���Ũ����0.100 mol��L��1����Ϊ0.040 mol��L��1�����ʵ���Ũ�ȱ仯Ϊ0.060 mol��L��1�����ݹ�ʽv=��c/��t���㣬v (N2O4)= 0.060 mol��L��1/60s=0.001 mol��L��1��s��1���������ͼ��֪������������ƽ��Ũ��Ϊ0.120 mol��L��1��������������ƽ��Ũ��Ϊ0.040 mol��L��1����Ϸ�ӦN2O4(g)
2NO2(g)֪�����¶����ߣ�����������ɫ��������������Ũ������˵��ƽ��������Ӧ�����ƶ��������¶ȶԻ�ѧƽ���Ӱ����ɣ�����������������ʱ�������¶ȣ�ƽ�������ȷ�Ӧ�����ƶ���֪���÷�Ӧ����Ӧ����Ϊ���ȷ�Ӧ����H����0���������ͼ��֪��0����60sʱ�Σ�N2O4�����ʵ���Ũ����0.100 mol��L��1����Ϊ0.040 mol��L��1�����ʵ���Ũ�ȱ仯Ϊ0.060 mol��L��1�����ݹ�ʽv=��c/��t���㣬v (N2O4)= 0.060 mol��L��1/60s=0.001 mol��L��1��s��1���������ͼ��֪������������ƽ��Ũ��Ϊ0.120 mol��L��1��������������ƽ��Ũ��Ϊ0.040 mol��L��1����Ϸ�ӦN2O4(g)![]() 2NO2(g)֪��K1= [NO2 ]2/[N2O4]= ��0.120mol��L��1��2/0.040mol��L��1=0.36 mol��L��1��
2NO2(g)֪��K1= [NO2 ]2/[N2O4]= ��0.120mol��L��1��2/0.040mol��L��1=0.36 mol��L��1��
��2��a����������֪���ı䷴Ӧ�¶�ΪT��c(N2O4)��0.0020 molL-1s-1��ƽ�����ʽ��ͣ�����ӦN2O4(g)![]() 2NO2(g)ƽ��������Ӧ�����ƶ����ָ÷�Ӧ����ӦΪ���ȷ�Ӧ���ʸı������Ϊ�����¶ȣ�T����1000C����Ϊ�����ڣ���Ӧ���������ȣ���Ӧ�����ȷ�����У����¶����ߣ�
2NO2(g)ƽ��������Ӧ�����ƶ����ָ÷�Ӧ����ӦΪ���ȷ�Ӧ���ʸı������Ϊ�����¶ȣ�T����1000C����Ϊ�����ڣ���Ӧ���������ȣ���Ӧ�����ȷ�����У����¶����ߣ�
b����������֪��ƽ��ʱ��c��NO2��=0.120 mol��L��1+0.002 mol��L��1��s��1��10s��2=0.160mol��L��1��
c��N2O4��=0.040 mol��L��1��0.002 mol��L��1��s��1��10s=0.02 mol��L��1��
K2= [NO2 ]2/[N2O4]= ��0.160mol��L��1��2/0.020mol��L��1=1.3mol��L��1��
��3����������֪����Ӧ��ƽ�����Ӧ�����������Сһ�룬������ѹǿ������ѹǿ�Ի�ѧƽ���Ӱ����ɣ�����������������ʱ������ѹǿ��ƽ������������ϵ����С�ķ����ƶ���֪����ӦN2O4(g)![]() 2NO2(g)��ƽ�����淴Ӧ�����ƶ�����Ϊ���淴Ӧ ���������������ķ�Ӧ������ѹǿƽ�����淴Ӧ�����ƶ���
2NO2(g)��ƽ�����淴Ӧ�����ƶ�����Ϊ���淴Ӧ ���������������ķ�Ӧ������ѹǿƽ�����淴Ӧ�����ƶ���

����Ŀ��ͨ����ú���ۺ����ÿɵõ��ྻ��ȼ�ϺͶ��ֻ���ԭ�ϣ�Ҳ�ɼ��ٻ�������Ⱦ��ú�ļ��Һ���ɵõ��״���
��1����֪��CH3OH��H2��ȼ���ȣ���H���ֱ�Ϊ��726.5kJ/mol����285.8kJ/mol��������CO2��H2��Ӧ����CH3OH��H2O���Ȼ�ѧ����ʽ��____________��
��2��һ�������£�CO��H2�ϳ�CH3OH��CO(g)+2H2(g)![]() CH3OH(g)��
CH3OH(g)��
�������һ�����ܱ������а����ʵ���֮��1:2����CO��H2�����ƽ��������CH3OH����������ڲ�ͬѹǿ�����¶ȵı仯��ͼ��ʾ��
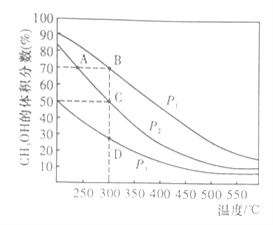
A��B��C����ƽ�ⳣ��KA��KB��KC�Ĵ�С��ϵ��___________��ѹǿ��P1____P2�����������������=����
�淴Ӧ���ʣ�v��(A)______v��(B)�����������������=����
��C�㣬CO��ת����Ϊ__________��
��C�㣬���ٰ����ʵ���֮��1:2����һ������CO��H2���������������䣬�ﵽ�µ�ƽ��ʱ��CH3OH���������__________�����������С�����䡱����
�����ں��º��������£��ܱ�ʾ�ÿ��淴Ӧ�ﵽƽ��״̬����__________��
A. ���������ܶȱ��ֲ���
B. ��������ƽ����Է����������ֲ���
C. �����ڵ�ѹǿ���ֲ���
D. ��λʱ����ÿ����1molCO��ͬʱ������2molH2
E. CO��H2��CH3OH��Ũ�ȱ��ֲ���
F. CO��H2��CH3OH��Ũ��֮��Ϊ1:2:1
��3�������ᡢ̼���Ϊ��Ԫ���ᣬ�䳣���µĵ��볣�����±���
H2CO3 | H2S | |
Ka1 | 4.4��10��7 | 1.3��10��7 |
Ka2 | 4.7��10��11 | 7.1��10��15 |
ú�����������в������к�����H2S����������Na2CO3��Һ���գ��÷�Ӧ�����ӷ���ʽΪ________�������£�0.1mol��L��1NaHCO3��Һ��0.1mol��L��1NaHS��Һ��pH��ȣ�pH��С��Ϊ______��Һ���ѧʽ����