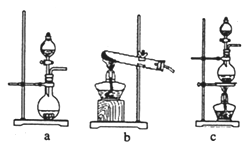
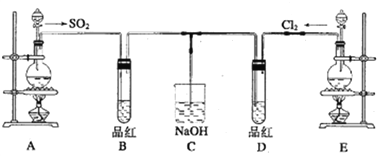
��Ŀ����
����Ŀ��ij�����Ĺ�ҵ��ˮ�к��д�����FeSO4���϶��Cu2+��������Na+��Ϊ�˼�����Ⱦ�����Ϊ���������ƻ��Ӹ÷�ˮ�л������������ͽ���ͭ��ij���������������ͼ����ɻ�������������ͭ�ļ�ʵ�鷽����
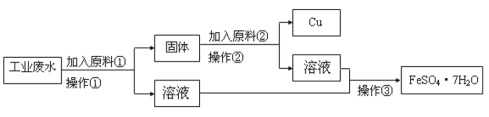
(1)�����ٵ�����Ϊ______���ò�������Ҫ�IJ�������Ϊ______��_____���ձ���
(2)ԭ�ϢڵĻ�ѧʽΪ__________�����������ӷ���ʽΪ_________________��
(3)Ϊ��֤��������ͼ�е���Һ�к���SO42-��ȡ��������Һ���Թ��У��ȼ���______���ټ���________�����۲쵽��__________����˵����Һ�к���SO42-��
���𰸡����� ©�� ������ H2SO4 Fe+2H+=Fe2++H2�� ����ϡ���� ����BaCl2��Һ ��ɫ����
��������
��ҵ��ˮ�к���������������Cu2+��������Na+���Ӹ÷�ˮ�л������������ͽ���ͭ��������̿�֪����ΪFe��������Ϊ���ˣ���Һ����Ҫ�����������������к�Cu��Fe�������ΪH2SO4��������Ϊ���ˣ��õ�Cu��������Ϊ����Ũ������ȴ�ᾧ�����ˣ��ɵõ�FeSO4��7H2O���Դ������
��1�������ٵõ��������Һ��������Ϊ���ˣ�����Ҫ�IJ�������Ϊ©�������������ձ���
��2�����ڼ����˹���������ͭ�����û�����ͭ����Ӧ�������������ù���������ͭ�Ļ���Ҫ�õ�����ͭ����ԭ�Ϣ������ᣬ��ѧʽΪH2SO4�����������ӷ���ʽΪFe+2H+��Fe2++H2����
��3��Ҫ��֤��Һ�к�����������ӣ���Ҫ�ų��������ӵĸ��ţ���ȡ��������Һ���Թ��У��ȼ�������ϡ���ᣬ�ټ�������BaCl2��Һ�����۲쵽�а�ɫ��������˵����Һ�к���SO42-��

 ��У����ϵ�д�
��У����ϵ�д�