题目内容
【题目】碘是人体中不可缺少的元素,为了防止碘缺乏,现在市场上流行一种加碘盐,就是在精盐中添加一定量的KIO3进去。某研究小组为了检测某加碘盐中是否含有碘,查阅了有关的资料,发现其检测原理是:
KIO3+5KI+3H2SO4=3I2+3H2O+3K2SO4
(1)用双线桥表示该反应中电子转移的方向和数目,该反应中还原产物与氧化产物的物质的量之比是____,0.2mol KIO3参加反应时转移电子____mol。
(2)实验结束后分离I2和K2SO4溶液所用的试剂是_______。
A.CCl4 B.酒精 C.Na2SO4溶液 D.食盐水
所用的分离方法是______,所用主要玻璃仪器是_____________。
(3)上面实验中用到一定物质的量浓度的稀硫酸,若配制1mol/L的稀硫酸溶液480mL,需用18mol/L浓H2SO4____mL,配制中需要用到的主要玻璃仪器是(填序号)______。
A.100mL量筒 B.托盘天平 C.玻璃棒 D.100mL容量瓶 E.50mL 量筒 F.胶头滴管 G.烧杯 H.500mL容量瓶
(4)下面操作造成所配稀硫酸溶液浓度偏高的是_______________
A.溶解后溶液没有冷却到室温就转移
B.转移时没有洗涤烧杯、玻璃棒
C.向容量瓶加水定容时眼睛俯视液面
D.用量筒量取浓硫酸后洗涤量筒并把洗涤液转移到容量瓶
E.摇匀后发现液面低于刻度线,又加蒸馏水至刻度线
【答案】 1:51A萃取、分液分液漏斗27.8CEFGHACD
1:51A萃取、分液分液漏斗27.8CEFGHACD
【解析】
试题(1)氧化还原反应KIO3+5KI+3H2SO4═3K2SO4+3I2+3H2O中,I元素的化合价由+5价降低为0,I元素的化合价由-1价升高为0,化合价升高值=化合价降低值=转移电子数=5,电子转移情况如下: ;KI为还原剂,+5价的I元素被还原,还原产物与氧化产物均为碘,由原子守恒及反应可知,物质的量之比为1:5;根据反应方程式得1mol KIO3参加反应 时转移电子5mol,则0.2mol KIO3参加反应时转移电子0.2×5mol=1mol。
;KI为还原剂,+5价的I元素被还原,还原产物与氧化产物均为碘,由原子守恒及反应可知,物质的量之比为1:5;根据反应方程式得1mol KIO3参加反应 时转移电子5mol,则0.2mol KIO3参加反应时转移电子0.2×5mol=1mol。
(2)A、碘易溶于有机溶剂,在四氯化碳在的溶解度远大于在水中,所以A正确;B、酒精与水互溶,所以B错误;C、Na2SO4溶液与K2SO4溶液互溶,所以C错误;D、食盐水与K2SO4溶液互溶,所以D错误;答案选A。分离方法是萃取分液,所以用分液漏斗;
(3)设浓硫酸的体积为VmL,稀释前后溶质物质的量不变,则:1 mol/L×0.5L="18" mol/LV×10-3,解得V=27.8mL;配制中需要用到的主要玻璃仪器是C.玻璃棒 E.50mL 量筒 F.胶头滴管 G.烧杯 H.500mL容量瓶。
(4)A.未冷却到室温就将溶液转移到容量瓶并定容,溶液冷却后体积偏小,配制的溶液浓度偏高,故A正确; B.转移时没有洗涤烧杯、玻璃棒,导致配制的溶液中溶质的物质的量偏小,配制的溶液浓度偏低,故B错误;C.定容时俯视刻度线,导致加入的蒸馏水体积偏小,配制的溶液体积偏小,溶液浓度偏高,故C正确;D.洗涤量筒,溶质的物质的量偏大,配制的溶液浓度偏高,故D正确;
E.又加蒸馏水至刻度线,配制的溶液体积偏大,溶液浓度偏小,故E错误.故答案为:ACD

 暑假衔接培优教材浙江工商大学出版社系列答案
暑假衔接培优教材浙江工商大学出版社系列答案 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案【题目】25℃时,有关物质的电离平衡常数如下:
化学式 | CH3COOH | H2CO3 | H2SO3 |
电离平衡常数 | K=1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | K1=1.5×10-2 K2=1.02×10-7 |
(1)请写出H2SO3的电离平衡常数K1的表达式:________________。
(2) 常温下,将体积为10mL pH=2的醋酸溶液与亚硫酸溶液分别加蒸馏水稀释至1000mL,稀释后溶液的pH,前者_____后者(填“>”、“<”或“=”)。
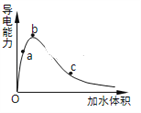
(3)一定条件下,冰醋酸加水稀释过程中溶液导电能力I随加水体积V变化曲线如右图所示,则a、b、c三点溶液醋酸的电离程度由大到小为____________________。
(4)下列离子CH3COO-、CO32-、HSO3-、SO32-在溶液中结合H+的能力由大到小的关系为___________。
(5)体积相同、c(H+)相同的①CH3COOH;②HCl;③H2SO4 三种酸溶液分别与同浓度的NaOH溶液完全中和时,消耗NaOH溶液的体积由大到小的排列顺序是_____(填序号)。
(6)已知,H+(aq) + OH-(aq) == H2O(l) ΔH =-57.3 kJ/mol。实验测得稀醋酸与稀NaOH溶液反应生成1 mol H2O时放出57 kJ的热,则醋酸溶液中,醋酸电离的热化学方程式为________________。