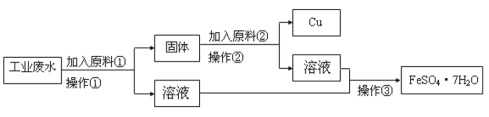
题目内容
【题目】氯气是一种重要的工业原料。
(1)实验室可用高锰酸钾和浓盐酸反应制取氯气,反应的化学方程式是:__________。
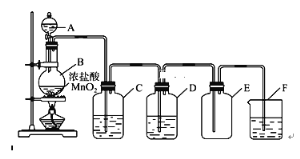
(2)资料显示:Ca(ClO)2+CaCl2+2H2SO4![]() 2CaSO4+2Cl2↑+2H2O。某学习小组利用此原理设计如图所示装置制取氯气并探究其性质:
2CaSO4+2Cl2↑+2H2O。某学习小组利用此原理设计如图所示装置制取氯气并探究其性质:

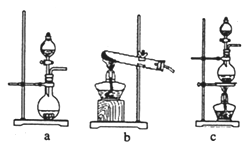
①在该实验中,甲部分的装置是__________(填字母)。
如何检查该装置的气密性?__________________________________________。
②乙装置中FeCl2溶液与Cl2:反应的离子方程式是_______________。
③丙装置中通人少量Cl2,可制得某种生活中常用的漂白、消毒的物质。已知碳酸的酸性强于次氯酸,则丙中发生反应的化学方程式是____________。
④该实验存在明显的缺陷,改进的方法________________________________。
【答案】2KMnO4+16HCl(浓)===2KCl+2MnCl2+5Cl2↑+8H2Oc关闭分液漏斗活塞,将导气管末端伸入盛水的烧杯中,用手捂热烧瓶,导气管口有气泡冒出,冷却后,导气管末端形成一段稳定的水柱2Fe2++Cl2 = 2Fe3++2Cl-Cl2+2Na2CO3 +H2O=NaCl+NaClO+2NaHCO3在丙装置后连接一个盛有氢氧化钠溶液的洗气瓶
【解析】
(1)实验室可用高锰酸钾和浓盐酸反应制取氯气,反应的化学方程式是2KMnO4+16HCl(浓)===2KCl+2MnCl2+5Cl2↑+8H2O;(2)①A部分是氯气发生装置,而此装置为固液加热型装置,a装置适用于固液不加热型,b适用于固体加热型,c适用于固液加热型,故选c;检查该装置的气密性的方法是关闭分液漏斗活塞,将导气管末端伸入盛水的烧杯中,用手捂热烧瓶,导气管口有气泡冒出,冷却后,导气管末端形成一段稳定的水柱,说明气密性良好。②乙装置中FeCl2溶液与Cl2反应离子方程式是2Fe2++Cl2 =2Fe3++2Cl-;③Cl2+2Na2CO3 +H2O=== NaCl+NaClO+2NaHCO3,④整个反应过程中由于氯气具有毒性,因此装置的末尾应加上一个尾气处理装置,可用碱性溶液吸收。