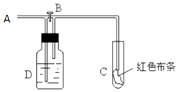
题目内容
【题目】把含硫酸铵和硝酸铵的混合液a L分成两等份.一份加入含b mol NaOH的溶液并加热,恰好把NH3全部赶出;另一份需消耗c mol BaCl2才能使SO42﹣完全沉淀,则原溶液中NO3﹣的物质的量浓度为( )
A. ![]() B.
B. ![]() C.
C. ![]() D.
D. ![]()
【答案】B
【解析】bmolNaOH恰好将NH3全部赶出,根据NH4++OH-![]() NH3↑+H2O可知,每份中含有bmol NH4+;与氯化钡溶液完全反应消耗c mol BaCl2才能使SO42﹣完全沉淀,根据Ba2++SO42-=BaSO4↓可知每份含有SO42﹣cmol,设每份中含有NO3﹣的物质的量为xmol,根据溶液呈现电中性,则bmol×1=cmol×2+xmol×1,得x=(b-2c)mol,因将a L混合液分成两等份,则每份的体积是0.5aL,所以每份溶液中NO3﹣的浓度是c(NO3﹣)=
NH3↑+H2O可知,每份中含有bmol NH4+;与氯化钡溶液完全反应消耗c mol BaCl2才能使SO42﹣完全沉淀,根据Ba2++SO42-=BaSO4↓可知每份含有SO42﹣cmol,设每份中含有NO3﹣的物质的量为xmol,根据溶液呈现电中性,则bmol×1=cmol×2+xmol×1,得x=(b-2c)mol,因将a L混合液分成两等份,则每份的体积是0.5aL,所以每份溶液中NO3﹣的浓度是c(NO3﹣)= ![]() =
= ![]() mol/L,即原溶液中NO3﹣的浓度是
mol/L,即原溶液中NO3﹣的浓度是![]() mol/L,故选B。
mol/L,故选B。

练习册系列答案
 教学练新同步练习系列答案
教学练新同步练习系列答案 课前课后同步练习系列答案
课前课后同步练习系列答案 课堂小作业系列答案
课堂小作业系列答案 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案 成功训练计划系列答案
成功训练计划系列答案 倍速训练法直通中考考点系列答案
倍速训练法直通中考考点系列答案
相关题目
【题目】基态X、Y、Z原子的核外电子排布式如下表,则下列化合物中不存在的是
基态原子的核外电子排布式 | |
X | 1S22S22P4 |
Y | 1S22S22P63S1 |
Z | 1S22S22P63S23P4 |
A.Y2ZX3B.Y2X2C.YZD.ZX3