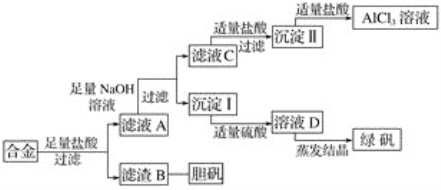
题目内容
【题目】利用下列实验装置进行相应的实验,不能达到实验目的的是
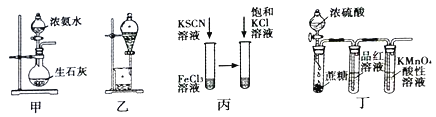
A. 利用图甲装置,可快速制取氨气
B. 利用图乙装置,用饱和碳酸钠溶液分离CH3CH2OH和CH3COOC2H5混合液
C. 利用图丙,可验证增加反应物浓度对化学平衡的影响
D. 利用图丁装置,可说明浓H2SO4具有脱水性、强氧化性,SO2具有漂白性,还原性
【答案】C
【解析】浓氨水与生石灰混合可制备氨气,则图中固液装置可制备氨气,A正确;饱和碳酸钠溶液与乙醇互溶,与乙酸乙酯分层,则图中分液装置可分离,B正确;硫氰化钾溶液与氯化铁反应本质:Fe3++3SCN-![]() Fe(SCN)3,所以加入氯化钾饱和液,对该平衡无影响,C错误;浓硫酸使蔗糖脱水后,C与浓硫酸反应生成二氧化碳、二氧化硫,二氧化硫使品红褪色,与高锰酸钾发生氧化还原反应,则图中装置可说明浓
Fe(SCN)3,所以加入氯化钾饱和液,对该平衡无影响,C错误;浓硫酸使蔗糖脱水后,C与浓硫酸反应生成二氧化碳、二氧化硫,二氧化硫使品红褪色,与高锰酸钾发生氧化还原反应,则图中装置可说明浓![]() 具有脱水性、强氧化性,
具有脱水性、强氧化性,![]() 具有漂白性、还原性,D正确;正确选项C。
具有漂白性、还原性,D正确;正确选项C。

 名校课堂系列答案
名校课堂系列答案【题目】某学习小组探究铁和硝酸银溶液的反应,实验过程如下:
实验序号 | 实验操作 | 实验现象 |
I | 将一束光亮洁净的铁丝伸入到0.1mol/L 的AgNO3溶液中 | 铁丝表面有银白色固体析出,溶液逐渐变为浅绿色 |
II | 取少量实验I中上层清液,滴入K3[Fe(CN) 6]溶液 | 有蓝色沉淀生成 |
(1)根据上述实验现象,甲同学认为有Fe2+生成,铁和硝酸银溶液的反应的离子方程式是____________________。
(2)乙同学认为实验中可能生成Fe3+,设计并完成如下实验
实验序号 | 实验操作 | 实验现象 |
III | 取少量实验I中上层清液,滴入少量KSCN溶液,振荡 | 产生白色沉淀,溶液局部变红,振荡后红色消失,沉淀量增加 |
查阅资料:Ag+与SCN-生成白色沉淀AgSCN
乙同学判断有Fe3+,理由是 ____________________。
(3)乙同学继续探究红色褪去的原因,设计并完成如下实验
实验序号 | 实验操作 | 实验现象 |
IV | 取少量实验I中上层清液,滴加几滴稀盐酸 | 有白色沉淀生成 |
V | 取1mLFe(NO3)3溶液,滴加2滴等浓度的KSCN溶液,振荡,再滴加少量AgNO3溶液 | 溶液变红;振荡溶液颜色无变化,滴加AgNO3后溶液红色褪去,产生白色沉淀. |
① 实验IV的目的是____________________;
② 用平衡移动原理解释,实验V中溶液红色褪去的原因____________________。
(4)丙认为溶液中Fe3+是Fe2+被Ag+氧化所致。按下图连接装置并进行实验,一段时间后取出左侧烧杯溶液加入KSCN溶液,溶液变红

① 其中X溶液是____________________;
② 由实验得出Ag+和Fe2+反应的离子方程式是____________________;
③ 丙同学的实验设计及结论是否合理,请说明理由____________________。
【题目】海水中蕴藏着丰富的资源,海水综合利用的流程图如图1: 
(一)某化学研究小组用图装置2模拟步骤I电解食盐水 (用铁和石墨做电极).
(1)a电极材料是(填铁、石墨),其电极反应式为 .
(2)当阴极产生11.2mL气体时(标准状况),该溶液的pH为(忽略反应前后溶液体积的变化). (二)卤水中蕴含着丰富的镁资源,就MgCl2粗产品的提纯、镁的冶炼过程回答下列问题:已知MgCl2粗产品的溶液中含有Fe2+、Fe3+和Al3+ . 表是生成氢氧化物沉淀的pH:
物质 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 | Mg(OH)2 |
开始沉淀pH | 2.7 | 8.1 | 3.8 | 9.5 |
完全沉淀pH | 3.7 | 9.6 | 4.8 | 11.0 |
(3)把MgCl2粗产品的溶液中的Fe2+转化为Fe3+ , 最适宜选用的物质是(填序号,下同),加入调节溶液的pH,充分反应后过滤,可得MgCl2溶液. a.KMnO4 b.H2O2 c.MgO d.NaOH
(4)步骤Ⅲ由MgCl2H2O获得MgCl2的操作是: .