题目内容
二氧化硫和氯气是中学化学中的常见气体,探究二者的制法和性质是十分重要的课题。
(1)实验室可由多种途径制取SO2。
途径I:Na2SO3固体与较浓的硫酸(约70%)反应制取;
途径II:铜与浓硫酸加热制取。
如果要在实验室制取SO2,选用上述两种方法中的 (填“途径I”或“途径II”)更合理,你的理由是 (答出一点就可)。
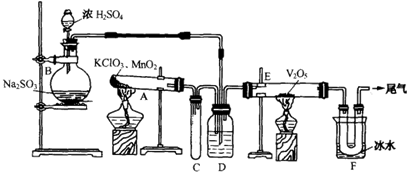
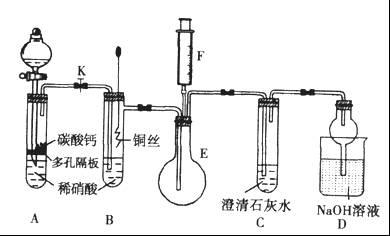
(2)如图是用KMnO4与浓盐酸反应制取适量氯气的简易装置。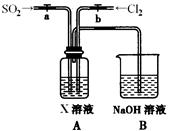
已知:2 KMnO4+16HCl(浓)= 2KCl+2MnCl2+5Cl2↑+8H2O。装置B、C、D的作用分别是:
B: ;
C: ;
D: 。
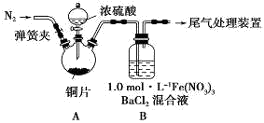
(3)某同学设计用如下装置探究二氧化硫、氯气的化学性质。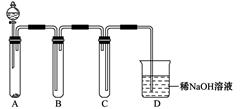
通过控制弹簧夹a、b,向装置A中分别通入不同气体,请完成如下问题:
①若关闭b,打开a,若X为品红溶液,则A中的现象为: ,说明二氧化硫具有 性。
②若关闭a,打开b,若X为紫色石蕊试液,则A中的现象为: ,原因是 。
③若同时打开a、b,且通入的气体体积比为1:1,若X为紫色石蕊试液,则A中的现象为 ,与②现象不同的原因是 (书写相应的化学方程式)。
(1)途径I(1分) 制备等量的二氧化硫消耗的硫酸少(合理即可) (1分)
(2)B:向上排空气收集氯气(1分)
C:安全瓶作用:防止D中的液体倒吸进入集气管B中(1分)
D:吸收尾气,防止氯气扩散到空气中污染环境(1分)
(3)①溶液红色褪去(1分) 漂白(1分)
②溶液紫色先变红,后褪色(1分)氯气与水反应生成的盐酸使紫色变为红色,同时生成的HClO具有漂白性,使溶液红色褪去(2分)
③溶液由紫色变为红色(1分) Cl2+SO2+2H2O=2HCl+H2SO4(2分)
解析试题分析:(1)途径I的反应为Na2SO3+H2 SO4 =SO2+Na2SO4+ H2O ,途径II反应为Cu+2H2SO4(浓) =△= CuSO4+SO2↑+ 2H2O,由两反应可知生成等量的SO2 途径I需要的浓硫酸少。
由图可知B装置为收集装置,氯气的密度比空气的密度大,故作用为向上排空气收集氯气。C装置为防止D装置中的溶液进入C中,D中氢氧化钠溶液吸收氯气。(3)①SO2具有漂白性,能使品红褪色
②氯气与水反应生成的盐酸使紫色变为红色,同时生成的 HClO 具有漂白性,使溶液红色褪去
③通入的气体体积比为1:1二者恰恰完全反应 Cl2+SO2+2H2O=2HCl+H2SO4生成的酸使溶液由紫色变为红色
考点:考查Cl2和SO2 的制法及化学性质

某兴趣小组设计如下图实验装置进行实验。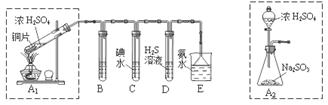
Ⅰ、探究大气污染物SO2的性质
(1)为了实现绿色环保的目标,能否用上图A2代替A1装置 (填“能”或“否”)。
(2)B、C、D分别用于检验SO2的漂白性、还原性和氧化性,则B中所盛试剂为 ,C中反应的离子方程式为 ,D中反应的化学方程式为 。
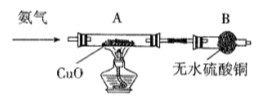
Ⅱ、探究铜片与浓H2SO4反应的产物
实验结束,发现在铜片表面附着黑色固体。查阅资料得知:此黑色固体可能含有CuO、CuS、Cu2S。常温下CuS和Cu2S都不溶于稀盐酸,在空气中煅烧都转化为Cu2O和SO2。该小组同学收集一定量黑色固体,按如下实验方案探究其成分: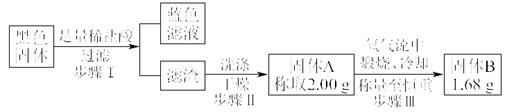
(3)步骤Ⅱ 中检验滤渣洗涤干净的实验方法是_____________________________。
(4)黑色固体的成分是________________。
Ⅲ、尾气处理
用氨水吸收尾气中的SO2,“吸收液”中可能含有OH-、SO32-、SO42-、HSO3-等阴离子。
(5)氨水吸收过量SO2的反应的离子方程式为 。
(6)已知亚硫酸氢盐一般易溶于水,SO2也易溶于水。
现有仪器和试剂为:小烧杯、试管、玻璃棒、胶头滴管、过滤装置和滤纸;2 mol/L盐酸、
2 mol/LHNO3、1 mol/LBaCl2溶液、l mol/LBa(OH)2溶液、品红溶液、蒸馏水。请设计实验证明“吸收液”中存在SO32-、HSO3-,完成下表的实验操作、预期现象和结论:
| 实验操作 | 预期现象与结论 |
| 步骤1:取适量“吸收液”于小烧杯中,用胶头滴管取l mol/L BaCl2溶液向小烧杯滴加直至过量。 | 若出现白色浑浊,则“吸收液” 中存在SO32-或 SO42-。 |
| 步骤2:将小烧杯中的浊液过滤、洗涤,再用适量水把附在滤纸上的固体冲入另一小烧杯中;向冲下的固体 。 | , 则“吸收液”中存在 SO32-。 |
| 步骤3: 。 | , 则“吸收液”中存在 HSO3-。 |
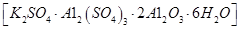 制备无水氯化铝的流程如下:
制备无水氯化铝的流程如下: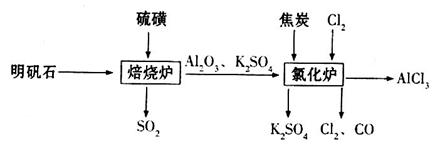
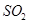 的方法是________________________________。
的方法是________________________________。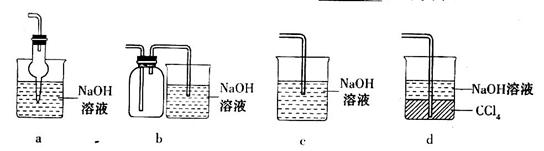
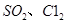 等大气污染物,若将二者按照一定比例通入水中可减少或消除污染。试设计简单实验检验二者是否恰好完全反应。(简要描述实验步骤、现象和结论)
等大气污染物,若将二者按照一定比例通入水中可减少或消除污染。试设计简单实验检验二者是否恰好完全反应。(简要描述实验步骤、现象和结论)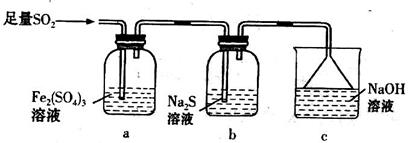
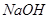 溶液的作用是________________。
溶液的作用是________________。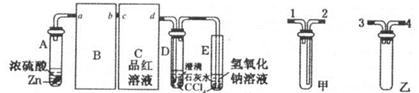

 Fe2O3 + 2Al
Fe2O3 + 2Al