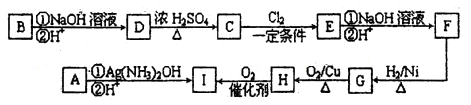
题目内容
无水氯化铝是一种重要的化工原料,利用明矾石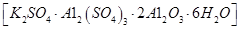 制备无水氯化铝的流程如下:
制备无水氯化铝的流程如下: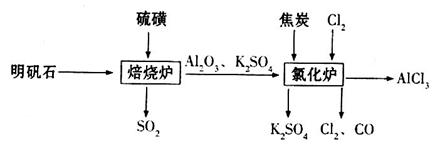
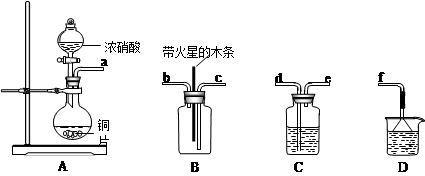
(1)验证焙烧炉产生的气体含有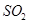 的方法是________________________________。
的方法是________________________________。
(2)吸收焙烧炉中产生的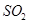 ,下列装置合理的是________(填代号)。
,下列装置合理的是________(填代号)。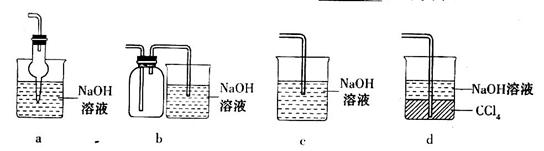
(3)氯化炉中发生反应的化学方程式为_________________________________________。
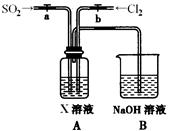
(4)生产氯化铝的过程中产生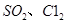 等大气污染物,若将二者按照一定比例通入水中可减少或消除污染。试设计简单实验检验二者是否恰好完全反应。(简要描述实验步骤、现象和结论)
等大气污染物,若将二者按照一定比例通入水中可减少或消除污染。试设计简单实验检验二者是否恰好完全反应。(简要描述实验步骤、现象和结论)
__________________________________________________________________________。
仪器自选;可供选择试剂如下:
①滴加酚酞的氢氧化钠溶液 ②氯化亚铁溶液 ③硫氰化钾溶液 ④品红溶液
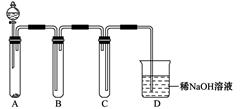
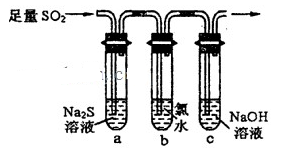
(5)某学习小组设计用如下装置验证二氧化硫的某些化学性质。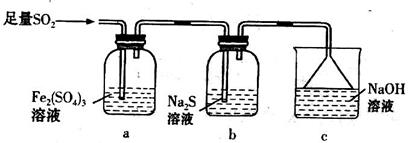
①能说明二氧化硫具有氧化性的实验现象为_____________________________________。
②写出a瓶中发生反应的离子方程式___________________________________________。
③充分反应后,取a瓶中的溶液分成三份,分别进行如下实验。
实验I:向第一份溶液中加入足量的NaOH溶液,生成白色沉淀,迅速变为灰绿色,最终变为红褐色
实验II:向第二份溶液中加入少量KMnO4溶液,紫色褪去
实验III:向第三份溶液中加入BaC12溶液,生成白色沉淀
上述实验中能证明二氧化硫具有还原性的是________(填实验代号)。
(1)将气体通入品红溶液,若品红褪色,加热后又变红,证明有SO2。
(2)ad
(3)3C+Al2O3+3Cl2  3CO+2 AlCl3
3CO+2 AlCl3
(4)取所得的溶液少许置于试管中,向其中加入品红溶液,若品红溶液不褪色,说明二者恰好完全反应;否则二者未完全反应。
(5)①b中出现淡黄色浑浊。
②2 Fe3++ SO2+2 H2O = SO42-+2 Fe2++4 H+
③Ⅰ和Ⅱ
解析试题分析:
(1)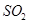 的检验试剂为品红,可以形成不稳定的有机化合物,变为无色,加热时有恢复。
的检验试剂为品红,可以形成不稳定的有机化合物,变为无色,加热时有恢复。
(2)尾气的吸收装置的考查,需要有防倒吸装置,b装置的防倒吸装置安全瓶的导管错误。c无防倒吸装置。
(3)见答案。
(4)取所得溶液少许置于试管中,向其中加入品红溶液,若品红溶液不褪色,说明二者恰好完全反应;否则,二者未完全反应。Cl2和SO2均可使品红褪色,原理不同。
(5)①b装置中有黄色物质析出,SO2将S2-氧化成S。
②Fe3+将SO2氧化成硫酸。
③实验I:向第一份溶液中加入足量的NaOH溶液,生成白色沉淀,迅速变为灰绿色,最终变为红褐色,说明有Fe2+存在。证明Fe3+将SO2氧化成硫酸,Fe3+被SO2还原为Fe2+。
实验II:向第二份溶液中加入少量KMnO4溶液,紫色褪去,SO2将KMnO4还原。
实验III:向第三份溶液中加入BaC12溶液,生成白色沉淀,说明有硫酸根存在。
考点:无机化学实验。

 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案 初中学业考试导与练系列答案
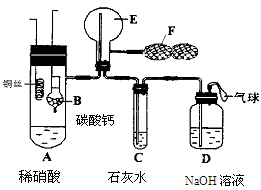
初中学业考试导与练系列答案甲、乙两同学用下图所示装置进行实验,探究硝酸与铁反应的产物。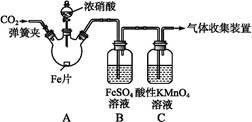
文献记载:Ⅰ.在浓硝酸与活泼金属反应过程中,随着硝酸浓度的降低,其生成的产物有+4、+2、-3价等氮的化合物。
Ⅱ.FeSO4+NO Fe(NO)SO4(棕色) ΔH<0。
Fe(NO)SO4(棕色) ΔH<0。
Ⅲ.NO2和NO都能被KMnO4氧化吸收。
甲的实验操作和现象记录如下:
| 实验操作 | 实验现象 |
| 打开弹簧夹,通入一段时间CO2,关闭弹簧夹。 | |
| 打开分液漏斗活塞,将浓硝酸缓慢滴入烧瓶中,关闭活塞。 | 无明显现象。 |
| 加热烧瓶,反应开始后停止加热。 | ①A中有红棕色气体产生,一段时间后,气体颜色逐渐变浅;B中溶液变棕色;C中溶液紫色变浅。 ②反应停止后,A中无固体剩余。 |
请回答下列问题:
(1)滴入浓硝酸加热前没有明显现象的原因是 。
(2)检验是否生成-3价氮的化合物,应进行的实验操作是 。
(3)甲取少量B中溶液,加热,实验现象是 。请用化学平衡原理解释原因: 。甲依据该现象得出的结论是A中有NO生成。
(4)乙认为甲得出A中有NO生成的证据不足。为获取充足的证据,乙仍采用该装置和操作进行对照实验,乙作出的改变是 ,证明有NO生成的实验现象是 。
(5)证明A溶液中含有Fe3+,选择的药品是(填序号) 。
A.铁粉 B.溴水 C.铁氰化钾溶液 D.硫氰化钾溶液
某兴趣小组设计如下图实验装置进行实验。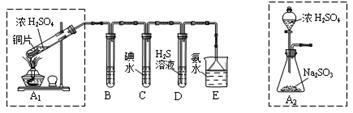
Ⅰ、探究大气污染物SO2的性质
(1)为了实现绿色环保的目标,能否用上图A2代替A1装置 (填“能”或“否”)。
(2)B、C、D分别用于检验SO2的漂白性、还原性和氧化性,则B中所盛试剂为 ,C中反应的离子方程式为 ,D中反应的化学方程式为 。
Ⅱ、探究铜片与浓H2SO4反应的产物
实验结束,发现在铜片表面附着黑色固体。查阅资料得知:此黑色固体可能含有CuO、CuS、Cu2S。常温下CuS和Cu2S都不溶于稀盐酸,在空气中煅烧都转化为Cu2O和SO2。该小组同学收集一定量黑色固体,按如下实验方案探究其成分:
(3)步骤Ⅱ中检验滤渣洗涤干净的实验方法是_____________________________。
(4)黑色固体的成分是________________。
Ⅲ、尾气处理
用氨水吸收尾气中的SO2,“吸收液”中可能含有OH-、SO32-、SO42-、HSO3-等阴离子。
(5)氨水吸收过量SO2的反应的离子方程式为 。
(6)已知亚硫酸氢盐一般易溶于水,SO2也易溶于水。现有仪器和试剂为:小烧杯、试管、玻璃棒、胶头滴管、过滤装置和滤纸;2 mol/L盐酸、2 mol/LHNO3、1 mol/LBaCl2溶液、l mol/LBa(OH)2溶液、品红溶液、蒸馏水。请设计实验证明“吸收液”中存在SO32-、HSO3-,完成下表的实验操作、预期现象和结论:
| 实验操作 | 预期现象与结论 |
| 步骤1:取适量“吸收液”于小烧杯中,用胶头滴管取l mol/L BaCl2溶液向小烧杯滴加直至过量。 | 若出现白色浑浊, 则“吸收液”中存在SO32-或 SO42-。 |
| 步骤2:将小烧杯中的浊液过滤、洗涤,再用适量水把附在滤纸上的固体冲入另一小烧杯中;向冲下的固体 。 | , 则“吸收液”中存在 SO32-。 |
| 步骤3: 。 | , 则“吸收液”中存在 HSO3-。 |
已知X、Y、Z、W均为中学化学中常见的单质或化合物,它们之间的转化关系如图所示(部分产物已略去)。则W、X不可能是( )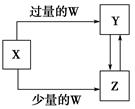
| 选项 | W | X |
| A | 盐酸 | Na2CO3溶液 |
| B | 稀HNO3 | Fe |
| C | CO2 | Ca(OH)2溶液 |
| D | O2 | Na |

 ,该反应中被氧化的元素是________(填元素符号)。
,该反应中被氧化的元素是________(填元素符号)。