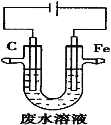
题目内容
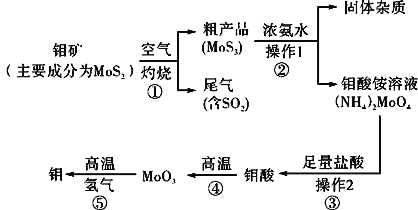
【题目】钼是一种过渡金属元素,通常用作合金及不锈钢的添加剂,这种元素可增强合金的强度、硬度、可焊接性及韧性,还可增强其耐高温及耐腐蚀性能。如图是化工生产中制备金属钼的主要流程图。
(1)反应①的尾气可以再利用,写出应用该尾气制得的两种重要化学试剂:___。
(2)如果在实验室模拟操作1和操作2,则需要使用的主要玻璃仪器有:___。
(3)钼在空气中灼烧生成三氧化钼,三氧化钼溶于氢氧化钠溶液生成钼酸钠;三氧化钼不溶于盐酸或稀硫酸。钼酸钠的化学式为___。
(4)工业上制备还原性气体CO和H2的反应原理为CO2+CH4![]() 2CO+2H2,CH4+H2O
2CO+2H2,CH4+H2O![]() CO+3H2。含甲烷体积分数为80%的a L(标准状况)天然气与足量二氧化碳和水蒸气的混合物在高温下反应,甲烷转化率为90%,用产生的还原性气体(CO和H2)还原MoO3制钼,理论上能生产钼的质量为___。
CO+3H2。含甲烷体积分数为80%的a L(标准状况)天然气与足量二氧化碳和水蒸气的混合物在高温下反应,甲烷转化率为90%,用产生的还原性气体(CO和H2)还原MoO3制钼,理论上能生产钼的质量为___。
【答案】H2SO4、Na2SO3[或Na2SO4、(NH4)2SO4等] 烧杯、漏斗、玻璃棒 Na2MoO4 4.11ag
【解析】
辉钼矿(主要成分是MoS2)在空气中燃烧生成MoO3和SO2,二氧化硫属于酸性氧化物,能被碱液吸收,所以尾气含SO2用浓氨水吸收,二氧化硫具有还原性,则同时通入氧气生成硫酸铵;MoO3加浓氨水生成钼酸铵溶液,过滤除去杂质,在钼酸铵溶液中加足量盐酸,发生复分解反应生成钼酸和氯化铵,钼酸为难溶于水和酸的黄色晶体,过滤得到钼酸晶体高温分解生成MoO3,在高温条件下用氢气还原得到金属钼。
(1)反应①的尾气主要为二氧化硫,二氧化硫可以用来制备硫酸、硫酸盐、亚硫酸等,故答案为:H2SO4、Na2SO3[或Na2SO4、(NH4)2SO4等];
(2)如果在实验室模拟操作1和操作2,该操作为过滤,过滤时需要的玻璃仪器有烧杯、漏斗和玻璃棒,故答案为:烧杯、漏斗和玻璃棒;
(3)三氧化钼溶于氢氧化钠溶液生成钼酸钠和水,结合步骤②的产物钼酸铵可知钼酸钠化学式为:Na2MoO4;
(4)根据![]() 、
、![]() 知,生成(CO+H2)体积是消耗甲烷体积的4倍,CO和氢气还原MoO3制钼时,每个分子CO和H2失去电子数相同,含甲烷体积分数为80%的a L(标准状况)天然气与足量二氧化碳和水蒸气的混合物在高温下反应,甲烷转化率为90%,则甲烷转化的物质的量=
知,生成(CO+H2)体积是消耗甲烷体积的4倍,CO和氢气还原MoO3制钼时,每个分子CO和H2失去电子数相同,含甲烷体积分数为80%的a L(标准状况)天然气与足量二氧化碳和水蒸气的混合物在高温下反应,甲烷转化率为90%,则甲烷转化的物质的量=![]() =0.0321amol,则生成CO和氢气物质的量之和为0.1284amol,根据转移电子守恒得生成Mo的质量= (0.1284a×
=0.0321amol,则生成CO和氢气物质的量之和为0.1284amol,根据转移电子守恒得生成Mo的质量= (0.1284a×![]() )×96g/mol=4.11ag,故答案为:4.11a g。
)×96g/mol=4.11ag,故答案为:4.11a g。