题目内容
原电池的电极名称不仅与电极材料的性质有关,也与电解质溶液有关,下列说法中不正确的是( )
| A.由Al、Cu、稀H2SO4组成原电池,放电时SO42-向Al电极移动 |
| B.由Mg、Al、NaOH溶液组成原电池,其负极反应式为:Al-3e-+4OH-===AlO2-+2H2O |
| C.由Al、Cu、浓硝酸组成原电池作电源,用石墨电极来电解硝酸银溶液,当析出1 mol Ag时,消耗铜电极32 g |
| D.由Fe、Cu、FeCl3溶液组成原电池,其负极反应式为:Cu-2e-===Cu2+ |
D
解析试题分析:A.由Al、Cu、稀H2SO4组成原电池,Al作负极,Cu作正极,根据同种电荷相互排斥,异种电荷相互吸引。所以放电时SO42-向正电荷较多的负极Al电极移动。正确。B.由Mg、Al、NaOH溶液组成原电池,Al作负极。其负极反应式为:Al-3e-+4OH-=AlO2-+2H2O。正确。C.由Al、Cu、浓硝酸组成原电池,由于Al在浓硝酸中会发生钝化,所以Cu作负极,Al作正极。该原电池作电源,用石墨电极来电解硝酸银溶液,因为在整个闭合回路中电子转移数目相等。当析出1 mol Ag时,电子转移1mol,则消耗的Cu的质量为32 g。正确。D.由Fe、Cu、FeCl3溶液组成原电池,Fe活动性比Cu强,作负极,Cu作正极。其负极反应式为:Fe-2e-=Fe2+.错误。
考点:考查影响原电池的电极名称的因素的知识。

关于如图所示装置的叙述,正确的是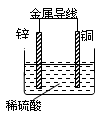
| A.锌是正极,铜片上有气泡产生 |
| B.铜片质量逐渐减少 |
| C.电流从锌片经导线流向铜片 |
| D.氢离子在铜片表面被还原 |
乙烯催化氧化成乙醛可设计成如下图所示的燃料电池,能在制备乙醛的同时获得电能,其总反应为:2CH2=CH2 + O2→ 2CH3CHO。 下列有关说法正确的是( )
| A.该电池为可充电电池 |
| B.电子移动方向:电极a→磷酸溶液→电极b |
| C.正极反应式为:CH2=CH2-2e- + 2OH- → CH3CHO + H2O |
| D.每有0.1mol O2反应,则迁移H+ 0.4mol |
某锂电池的电池总反应为4Li+2SOCl2=4LiCl+S+SO2,下列有关说法正确的是( )
| A.锂电极作电池负极,放电过程中发生还原反应 |
| B.1 mol SOCl2发生电极反应转移的电子数为4 mol |
| C.电池的正极反应为2SOCl2+2e-=4Cl-+S+SO2 |
| D.组装该电池必须在无水、无氧的条件下进行 |
镍镉(Ni—Cd)可充电电池在现代生活中有广泛应用,它的充放电反应按下式进行:
Cd(OH)2+2Ni(OH)2 Cd+2NiO(OH)+2H2O 由此可知,该电池放电时的负极材料是 ( )
Cd+2NiO(OH)+2H2O 由此可知,该电池放电时的负极材料是 ( )
| A.Cd(OH)2 | B.Ni(OH)2 | C.Cd | D.NiO(OH) |
已知蓄电池在充电时作电解池,放电时作原电池。铅蓄电池上有两个接线柱,一个接线柱旁标有“+”,另一个接线柱旁标有“—”。关于标有“+”的接线柱,下列说法中正确的是 ( )
| A.充电时作阳极,放电时作负极 | B.充电时作阳极,放电时作正极 |
| C.充电时作阴极,放电时作负极 | D.充电时作阴极,放电时作正极 |
报道,最近摩托罗拉公司研发了一种由甲醇和氧气以及强碱做电解质溶液的新型手机电池,电量可达现在使用的镍氢电池或锂电池的十倍,可连续使用一个月才充一次电。其电池反应为:
2CH3OH + 3O2 + 4OH—  2CO32— + 6H2O,则下列说法错误的是 ( )
2CO32— + 6H2O,则下列说法错误的是 ( )
| A.放电时CH3OH参与反应的电极为正极 |
| B.充电时电解质溶液的pH逐渐增大 |
| C.放电时负极的电极反应为:CH3OH-6e-+8OH- = CO32— + 6H2O |
| D.充电时每生成1 mol CH3OH转移6 mol电子 |
我国镍氢电池居世界先进水平,我军潜艇将装备国产大功率镍氢动力电池。常见镍氢电池的某极是储氢合金LaNi5H6(LaNi5H6中各元素化合价均可视为零价),电池放电时发生的反应通常表示为LaNi5H6+6NiO(OH)=LaNi5+6Ni(OH)2。下列说法正确的是
| A.放电时储氢合金作正极 |
| B.放电时负极反应为:LaNi5H6-6e-=LaNi5+6H+ |
| C.充电时阳极周围c(OH-)减小 |
| D.充电时储氢合金作负极 |
铜板上铁铆钉长期暴露在潮湿的空气中,形成一层酸性水膜后铁铆钉会被腐蚀,示意图如下。下列说法不正确的是
| A.因铁的金属性比铜强,所以铁铆钉被氧化而腐蚀 |
| B.若水膜中溶解了SO2,则铁铆钉腐蚀的速率变小 |
| C.铜极上的反应是2H+ + 2e- ="=" H2↑,O2 + 4e- + 4H+ ="=" 2H2O |
| D.在金属表面涂一层油脂,能防止铁铆钉被腐蚀 |