题目内容
我国镍氢电池居世界先进水平,我军潜艇将装备国产大功率镍氢动力电池。常见镍氢电池的某极是储氢合金LaNi5H6(LaNi5H6中各元素化合价均可视为零价),电池放电时发生的反应通常表示为LaNi5H6+6NiO(OH)=LaNi5+6Ni(OH)2。下列说法正确的是
| A.放电时储氢合金作正极 |
| B.放电时负极反应为:LaNi5H6-6e-=LaNi5+6H+ |
| C.充电时阳极周围c(OH-)减小 |
| D.充电时储氢合金作负极 |
C
解析试题分析:根据信息LaNi5H6中氢元素在放电时化合价升高,发生氧化反应,在负极上参与反应,NiO(OH)在正极上反应,电解质溶液应该为碱性,由此写出正负极的电极反应式分别为,正极:NiO(OH)+e-+H2O= Ni(OH)2+OH+,负极:LaNi5H6-6e-+6OH-=LaNi5+6H2O,由此可判断A、B项错误;充电时为电解池,储氢合金作阴极,D项错误,阳极的电极反应式为正极反应的逆反应:Ni(OH)2+OH+-e-= NiO(OH) +H2O,其阳极周围c(OH-)减小,C项正确。
考点:本题以“镍氢电池的充放电方程式”为素材,考查电化学原理、原电池的正负极判断及电极反应式的书写,电解池的阴阳极判断及电极反应式的书写与分析。

原电池的电极名称不仅与电极材料的性质有关,也与电解质溶液有关,下列说法中不正确的是( )
| A.由Al、Cu、稀H2SO4组成原电池,放电时SO42-向Al电极移动 |
| B.由Mg、Al、NaOH溶液组成原电池,其负极反应式为:Al-3e-+4OH-===AlO2-+2H2O |
| C.由Al、Cu、浓硝酸组成原电池作电源,用石墨电极来电解硝酸银溶液,当析出1 mol Ag时,消耗铜电极32 g |
| D.由Fe、Cu、FeCl3溶液组成原电池,其负极反应式为:Cu-2e-===Cu2+ |
一种新燃料电池,一极通入空气,另一极通入丁烷气体;电解质是掺杂氧化钇(Y2O3)的氧化锆(ZrO2)晶体,在熔融状态下能传导O2-。下列对该燃料说法正确的是 ( )
| A.在熔融电解质中,O2-由负极移向正极 |
| B.电池的总反应是:2C4H10 + 13O2 → 8CO2 + 10H2O |
| C.通入空气的一极是负极,电极反应为:O2 + 4e- = 2O2- |
| D.通入丁烷的一极是正极,电极反应为:C4H10 + 26e- + 13O2 = 4CO2 + 5H2O |
有关如下图所示原电池的叙述,正确的是(盐桥中装有含琼胶的KCl饱和溶液)
| A.铜片上有气泡逸出 |
| B.取出盐桥后,电流计依然发生偏转 |
| C.反应中,盐桥中的K+会移向CuSO4溶液 |
| D.反应前后铜片质量不改变 |
某充电电池的原理如图所示,溶液中c(H+)="2.0" mol ,阴离子为SO42-,a、b均为惰性电极,充电时右槽溶液颜色由绿色变为紫色。下列对此电池叙述正确的是
,阴离子为SO42-,a、b均为惰性电极,充电时右槽溶液颜色由绿色变为紫色。下列对此电池叙述正确的是
| A.放电过程中,左槽溶液颜色由黄色变为蓝色 |
| B.充电时,b极接直流电源正极,a极接直流电源负极 |
| C.充电过程中,a极的反应式为: VO2++2H++e-= VO2++H2O |
| D.放电时,H+从左槽迁移进右槽 |
一种太阳能电池的工作原理示意图如下所示,电解质为铁氰化钾K3[Fe(CN)6]和亚铁氰化钾K4[Fe(CN)6]的混合溶液,下列说法不正确的是( ) 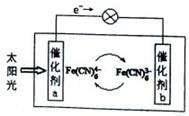
| A.K+移向催化剂b | B.催化剂a表面发生反应:Fe(CN)64――e-=Fe(CN)63- |
| C.Fe(CN)63-在催化剂b表面被氧化 | D.电解质溶液中Fe(CN)63-和Fe(CN)64-浓度基本保持不变 |
太阳能电池板面对太阳时,一部分电能直接供给“天宫一号”,一部分电能则储存在电池里,供背离太阳时使用。“天宫一号”使用的是镍氢电池,电解质溶液显碱性。其反应方程式为: LaNi5+Ni(OH)2 LaNi5H+NiOOH。下列有关说法不正确的是
LaNi5H+NiOOH。下列有关说法不正确的是
| A.放电时镍被还原 | B.放电时负极LaNi5H+OH——e—=LaNi5+H2O |
| C.充电时OH—向阴极移动 | D.充电时每消耗lmol Ni(OH)2转移lmol电子 |
如图所示,NaS电池是当前开发的一种高性能可充电电池,它所贮存的能量为常用铅蓄电池的5倍(按相同质量计),电池反应为
2Na(l)+S8(l) Na2Sn。下列说法不正确的是
Na2Sn。下列说法不正确的是
| A.外室熔融硫中添加石墨粉主要是为了增强导电性 |
| B.放电时Na+向正极移动 |
| C.充电时阳极反应式为8S-16e-===nS8 |
| D.充电时钠极与外接电源的正极相连 |
 Li2CoO2,下列说法不正确的是
Li2CoO2,下列说法不正确的是