题目内容
乙烯催化氧化成乙醛可设计成如下图所示的燃料电池,能在制备乙醛的同时获得电能,其总反应为:2CH2=CH2 + O2→ 2CH3CHO。 下列有关说法正确的是( )
| A.该电池为可充电电池 |
| B.电子移动方向:电极a→磷酸溶液→电极b |
| C.正极反应式为:CH2=CH2-2e- + 2OH- → CH3CHO + H2O |
| D.每有0.1mol O2反应,则迁移H+ 0.4mol |
D
解析试题分析:A、该电池是燃料电池,不能充电,A不正确;B、原电池中负极失去电子,乙烯在负极通入,但电子只能通过导线和电极传递,不能通过溶液传递,B不正确;C、正极得到电子,发生还原反应,因此氧气在正极放电,电极反应式为O2+4e- + 4H+ →2H2O, C不正确;D、根据O2+4e- + 4H+ →2H2O可知,每有0.1mol O2反应,则迁移H+ 0.4mol,D正确,答案选D。
考点:考查燃料电池的应用与判断

下列对如图所示装置实验判断的描述正确的是( )
| | a电极 | b电极 | X溶液 | 实验判断 |
| A | Cu | Zn | H2SO4 | H+向b极迁移 |
| B | Zn | Fe | H2SO4 | a、b极都放出无色气体 |
| C | Al | Mg | NaOH | a为负极,b为正极 |
| D | Cu | 石墨 | FeCl3 | a极质量减小,b极质量增加 |

2013年3月我国科学家报道了如图所示的水溶液锂离子电池体系。下列叙述错误的是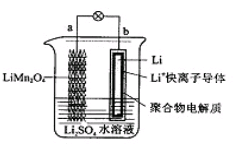
| A.a为电池的正极 |
B.电池充电反应为LiMn2O4 Li1-xMn2O4+xLi Li1-xMn2O4+xLi |
| C.放电时,a极锂的化合价发生变化 |
| D.放电时,溶液中Li+从b向a迁移 |
硫-钠原电池具有输出功率较高,循环寿命长等优点。其工作原理可表示为:2Na+xS Na2Sx。但工作温度过高是这种高性能电池的缺陷,科学家研究发现,采用多硫化合物(
Na2Sx。但工作温度过高是这种高性能电池的缺陷,科学家研究发现,采用多硫化合物(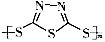 )作为电极反应材料,可有效地降低电池的工作温度,且原材料价廉、低毒,具有生物降解性。下列有关叙述正确的是
)作为电极反应材料,可有效地降低电池的工作温度,且原材料价廉、低毒,具有生物降解性。下列有关叙述正确的是
A.多硫化合物( )是一种新型无机非金属材料 )是一种新型无机非金属材料 |
B.多硫化合物(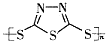 )化合物不能发生加成反应 )化合物不能发生加成反应 |
C.原电池的负极反应是将单体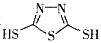 转化为 转化为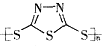 的过程 的过程 |
| D.当电路中有0.02mol电子通过时,原电池的负极将消耗原料0.46g |
气体的自动化检测中常常应用原电池原理的传感器。下图为电池的工作示意图:气体扩散进入传感器,在敏感电极上发生反应,传感器就会接收到电信号。下表列出了待测气体及敏感电极上部分反应产物。则下列说法中正确的是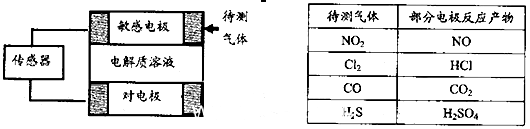
| A.上述气体检测时,敏感电极均作电池正极 |
B.检测Cl2气体时,敏感电极的电极反应为: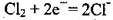 |
C.检测H2S气体时,对屯极充入空气,对电极上的电极反应式为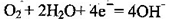 |
| D.检测H2S和CO体积分数相同的两份空气样本时,传感器上产生的电流大小相同 |
原电池的电极名称不仅与电极材料的性质有关,也与电解质溶液有关,下列说法中不正确的是( )
| A.由Al、Cu、稀H2SO4组成原电池,放电时SO42-向Al电极移动 |
| B.由Mg、Al、NaOH溶液组成原电池,其负极反应式为:Al-3e-+4OH-===AlO2-+2H2O |
| C.由Al、Cu、浓硝酸组成原电池作电源,用石墨电极来电解硝酸银溶液,当析出1 mol Ag时,消耗铜电极32 g |
| D.由Fe、Cu、FeCl3溶液组成原电池,其负极反应式为:Cu-2e-===Cu2+ |
某充电电池的原理如图所示,溶液中c(H+)="2.0" mol ,阴离子为SO42-,a、b均为惰性电极,充电时右槽溶液颜色由绿色变为紫色。下列对此电池叙述正确的是
,阴离子为SO42-,a、b均为惰性电极,充电时右槽溶液颜色由绿色变为紫色。下列对此电池叙述正确的是
| A.放电过程中,左槽溶液颜色由黄色变为蓝色 |
| B.充电时,b极接直流电源正极,a极接直流电源负极 |
| C.充电过程中,a极的反应式为: VO2++2H++e-= VO2++H2O |
| D.放电时,H+从左槽迁移进右槽 |
(3分)(2012?山东)下列与金属腐蚀有关的说法正确的是( )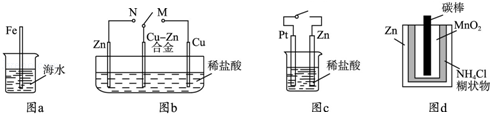
| A.图a中,插入海水中的铁棒,越靠近底端腐蚀越严重 |
| B.图b中,开关由M改置于N时,Cu﹣Zn合金的腐蚀速率减小 |
| C.图c中,接通开关时Zn腐蚀速率增大,Zn上放出气体的速率也增大 |
| D.图d中,Zn﹣MnO2干电池自放电腐蚀主要是由MnO2的氧化作用引起的 |
太阳能电池板面对太阳时,一部分电能直接供给“天宫一号”,一部分电能则储存在电池里,供背离太阳时使用。“天宫一号”使用的是镍氢电池,电解质溶液显碱性。其反应方程式为: LaNi5+Ni(OH)2 LaNi5H+NiOOH。下列有关说法不正确的是
LaNi5H+NiOOH。下列有关说法不正确的是
| A.放电时镍被还原 | B.放电时负极LaNi5H+OH——e—=LaNi5+H2O |
| C.充电时OH—向阴极移动 | D.充电时每消耗lmol Ni(OH)2转移lmol电子 |