题目内容
14.为了测定有机物A的组成和结构,称取A样品5.3g,使其完全燃烧,将生成物先后通过过量的无水CaCl2和碱石灰,两者分别增重 4.5g 和 17.6g(设生成物完全被吸收).现用下列方法测定该有机化合物的相对分子质量和分子结构.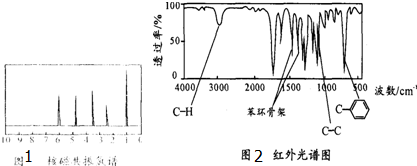
方法一:用质谱法分析得知A的相对分子质量为106.
方法二:核磁共振仪测出A的核磁共振氢谱有5个峰,其面积之比为l:2:2:2:3,如图1所示:
方法三:利用红外光谱仪测得A分子的红外光谱如图2所示.
回答下列问题:
(1)A的分子式为C8H10.
(2)A的分子中含一个甲基的依据是bc.
a.A的相对分子质量 b.A的分子式
c.A的核磁共振氢谱图d.A分子的红外光谱图
(3)A的结构简式为
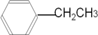 .
.
分析 (1)氯化钙增重 4.5g为水的质量,其物质的量为$\frac{4.5g}{18g/mol}$=0.25mol,则碱石灰增重17.6g为生成二氧化碳的质量,其物质的量为$\frac{17.6g}{44g/mol}$=0.4mol,C、H元素总质量为0.4mol×12g/mol+0.25mol×2×1g/mol=5.3g,等于有机物的质量,有机物只含C、H两种元素,根据元素守恒确定有机物分子式;
(2)A的核磁共振氢谱有5个峰,说明分子中有5种H原子,其面积之比为对应的各种H原子个数之比,根据分子式可知分子中H原子总数,进而确定甲基数目.
(3)根据A分子的红外光谱,核磁共振氢谱确定确定A的结构简式.
解答 解:(1)氯化钙增重 4.5g为水的质量,其物质的量为$\frac{4.5g}{18g/mol}$=0.25mol,则碱石灰增重17.6g为生成二氧化碳的质量,其物质的量为$\frac{17.6g}{44g/mol}$=0.4mol,C、H元素总质量为0.4mol×12g/mol+0.25mol×2×1g/mol=5.3g,等于有机物的质量,5.3g有机物的物质的量为$\frac{5.3g}{106g/mol}$=0.05mol,故该有机物有机物分子中C原子数目为$\frac{0.4mol}{0.05mol}$=8、H原子数目为$\frac{106-12×8}{1}$=10,则有机物分子式为C8H10,
故答案为:C8H10;
(2)A的核磁共振氢谱有5个峰,说明分子中有5种H原子,其面积之比为对应的各种H原子个数之比,由分子式可知分子中H原子总数,进而确定甲基数目,所以需要知道A的分子式及A的核磁共振氢谱图,
故答案为:bc;
(3)由A分子的红外光谱知,含有C6H5C-基团、C-C结构,A的核磁共振氢谱有5个峰,其面积之比为l:2:2:2:3,则A的结构简式为: ,故答案为:
,故答案为: .
.
点评 本题考查有机物分子式与结构式的确定,题目难度中等,本题易错点为(3),根据谱图写出符合条件的结构简式.

| 选项 | n(Cl2)/n(FeBr2) | 离子方程式 |
| A | 1:1 | 2Cl2+2Fe3++2Br-=2Fe3++Br2+4Cl- |
| B | 2:1 | 3Cl2+2Fe2++4Br-=2Fe3++2Br2+6Cl- |
| C | 1:2 | Cl2+2Br-=Br2+2Cl- |
| D | 2:3 | 4Cl2+62Fe2++2Br-=6Fe3++Br2+8Cl- |
| A. | A、 | B. | B、 | C. | C、 | D. | D、 |
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
| 2 | ① | ② | ||||||
| 3 | ⑨ | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
(2)表中最活泼的金属是Na,非金属最强的元素是F;(填写元素符号)
(3)表中能形成两性氢氧化物的元素是Al;
(4)⑨单质与水反应的化学方程式为2Na+2H2O=2NaOH+H2↑.

| A. | 不能发生水解反应和消去反应 | |
| B. | 能发生水解反应,条件是强碱的醇溶液且加热,被破坏的键是①和④ | |
| C. | 能发生消去反应,条件是强碱的水溶液且加热,被破坏的键是①和② | |
| D. | 发生水解反应时,被破坏的键是①;发生消去反应时,被破坏的键是①和③ |
| A. | C6H12 | B. | C6H6O6 | C. | C5H11COOH | D. | C6H5OH |
| A. | Cl2是双原子分子,H2S是三原子分子,这是由共价键的方向性决定的 | |
| B. | H2O与H2S的空间结构一样是由共价键的饱和性决定的 | |
| C. | 并非所有的共价键都有方向性 | |
| D. | 两原子轨道发生重叠后,电子在两核间出现的概率减小 |
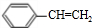 +Br2→
+Br2→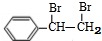 ;在一定条件下,由A聚合得到的高分子化合物的结构简式为
;在一定条件下,由A聚合得到的高分子化合物的结构简式为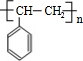 .
.