题目内容
2.下表为元素周期表的一部分,请回答有关问题:| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
| 2 | ① | ② | ||||||
| 3 | ⑨ | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
(2)表中最活泼的金属是Na,非金属最强的元素是F;(填写元素符号)
(3)表中能形成两性氢氧化物的元素是Al;
(4)⑨单质与水反应的化学方程式为2Na+2H2O=2NaOH+H2↑.
分析 由元素在周期表中的位置可知,①为N、②为F、③为Mg、④为Al、⑤为Si、⑥为S、⑦为Cl、⑧为Ar、⑨为Na.根据同周期自左而右金属性减弱、非金属性增强,同主族自上而下金属性增强、非金属性减弱判断金属性、非金属性最强的元素;结合有关元素及其化合物的性质分析.
解答 解:由元素在周期表中的位置可知,①为N、②为F、③为Na、④为Al、⑤为Si、⑥为S、⑦为Cl、⑧为Ar,
(1)⑤为Si名称为硅、⑧为Ar其名称为氩,
故答案为:硅 Si;氩Ar;
(2)根据同周期自左而右金属性减弱、非金属性增强,同主族自上而下金属性增强、非金属性减弱,故表中金属性最强为Na,非金属性最强的为F,
故答案为:Na;F;
(3)Al的氢氧化物氢氧化铝能与强酸、强碱反应,具有两性,
故答案为:Al;
(4)Na单质与水反应生成氢氧化钠和氢气,其反应的化学方程式为2Na+2H2O=2NaOH+H2↑;
故答案为:2Na+2H2O=2NaOH+H2↑.
点评 本题考查元素周期表与元素周期律的综合应用,难度不大,侧重学生对基础知识的巩固,把握周期表的结构、明确元素及其化合物的性质是解题的关键.

练习册系列答案
相关题目
12.某矿石的主要成分由前20号元素中的W、Y、Z、X四种组成.X、Y、Z、W分布在三个周期,其原子序数依次增大,W、Y为金属元素,X原子的最外层电子数是此外层电子数的3倍,W能与冷水剧烈反应,Y、Z原子的最外层电子数之和与X、W原子的最外层电子数之和相等,Y、Z位于同周期,Z的单质是一种良好的半导体,下列说法正确的是( )
| A. | W、X、Y、Z的原子半径依次减小 | |
| B. | 气态氢化物的稳定性:Z>X | |
| C. | Y、Z的氧化物都既能跟酸反应又能和碱反应,所以均为两性氧化物 | |
| D. | 该矿石的主要成分的化学式可能为:WYZ3X8 |
7.离子键的强弱主要决定于离子半径和离子电荷数,一般规律是:离子半径小,离子所带电荷值大,则离子键越强.①K2O ②MgO ③CaO三种物质离子键由强到弱的顺序是( )
| A. | K2O、MgO、CaO | B. | MgO、CaO、K2O | C. | MgO、K2O、CaO | D. | CaO、K2O、MgO |
12.某学习小组利用下列装置探究氯气和氨气之间的反应,其中A、F分别为氨气和氯气的发生装置,C为纯净干燥的氯气和氨气的反应装置.
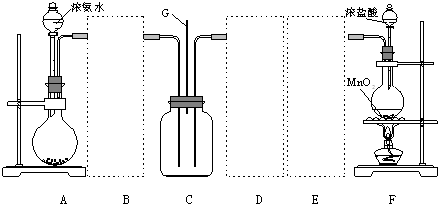
请回答下列问题:
(1)装置A中烧瓶内的固体可选用a、b.
a.烧碱 b.生石灰c.二氧化硅 d.五氧化二磷
(2)往装置A的烧瓶内加入粉末状固体的操作方法是:将烧瓶横放,将盛有药品药匙或小纸槽伸入瓶底,再将烧瓶竖起.
(3)虚线框内应添加必要的除杂装置,请从上图的备选装置中选择并将编号填入下列空格.
B碱石灰;E饱和食盐水(填编号).
(4)装置C内出现白烟并在容器内壁凝结,鉴定该固体是氯化铵所需要的试剂和试纸除蒸馏水外还有NaOH溶液和湿润的红色石蕊试纸;硝酸银溶液和稀硝酸.
(5)如果C中气体未出现红棕色,写出C中发生反应的化学方程式8NH3+3Cl2=6NH4Cl+N2.

| Ⅰ | Ⅱ | Ⅲ | |
| 备选 装置 | 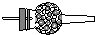 | 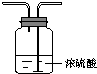 | 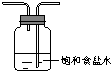 |
(1)装置A中烧瓶内的固体可选用a、b.
a.烧碱 b.生石灰c.二氧化硅 d.五氧化二磷
(2)往装置A的烧瓶内加入粉末状固体的操作方法是:将烧瓶横放,将盛有药品药匙或小纸槽伸入瓶底,再将烧瓶竖起.
(3)虚线框内应添加必要的除杂装置,请从上图的备选装置中选择并将编号填入下列空格.
B碱石灰;E饱和食盐水(填编号).
(4)装置C内出现白烟并在容器内壁凝结,鉴定该固体是氯化铵所需要的试剂和试纸除蒸馏水外还有NaOH溶液和湿润的红色石蕊试纸;硝酸银溶液和稀硝酸.
(5)如果C中气体未出现红棕色,写出C中发生反应的化学方程式8NH3+3Cl2=6NH4Cl+N2.

 、加聚反应.
、加聚反应.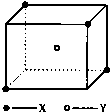 某离子晶体晶胞结构如图所示,x位于立方体的顶点,Y位于立方体中心.试分析:
某离子晶体晶胞结构如图所示,x位于立方体的顶点,Y位于立方体中心.试分析:
 .
.