题目内容
6.为了从海带中提取碘,某研究性学习小组设计并进行了如下实验: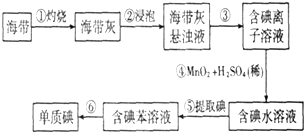
(1)步骤①灼烧海带时,除需要三脚架外,还需要用到的实验仪器是BDE(从下列仪器中选出所需仪器,用标号字母填写在横线上).
A.烧杯 B.坩埚 C.表面皿 D.泥三角 E.酒精灯 F.干燥器
(2)步骤③的实验操作名称是过滤;步骤⑤中实验操作名称是萃取步骤⑥的目的是从含碘苯溶液中分离出单质碘和回收苯,该步骤的实验操作名称是蒸馏.
(3)若向含碘离子的溶液中加入溴水也能反应,写出该反应的离子方程式2I-+Br2═2Br-+I2
(4)步骤④反应的离子方程式是2I-+MnO2+4H+═Mn2++I2+2H2O
(5)请设计一种检验提取碘后的水溶液中是否还含有单质碘的简单方法取少量提取碘后的水溶液于试管中,加入几滴淀粉试液,观察是否出现蓝色(如果变蓝,说明还有单质碘).
分析 由流程可知,海带灼烧后溶解,然后③过滤得到含碘离子的溶液,④发生2I-+MnO2+4H+═Mn2++I2+2H2O,⑤为萃取得到含碘的苯溶液,⑥为蒸馏得到单质碘,
(1)灼烧需要坩埚、泥三角、三角驾、酒精灯、坩埚钳;
(2)由流程可知③⑤⑥的分离方法;
(3)溴水能将碘离子氧化为碘单质;
(4)发生氧化还原反应生成碘、硫酸锰、水;
(5)碘单质遇到淀粉会变蓝色,以此来检验是否有碘单质.
解答 解:由流程可知,海带灼烧后溶解,然后③过滤得到含碘离子的溶液,④发生2I-+MnO2+4H+═Mn2++I2+2H2O,⑤为萃取得到含碘的苯溶液,⑥为蒸馏得到单质碘,
(1)灼烧需要坩埚、泥三角、三角驾、酒精灯、坩埚钳,则步骤①灼烧海带时,除需要三脚架外,还需要用到的实验仪器是BDE,故答案为:BDE;
(2)由流程可知③⑤⑥的分离方法分别为过滤、萃取、蒸馏,故答案为:过滤;萃取;蒸馏;
(3)溴水能将碘离子氧化为碘单质,离子反应为2I-+Br2═2Br-+I2,故答案为:2I-+Br2═2Br-+I2;
(4)发生氧化还原反应生成碘、硫酸锰、水,离子反应为2I-+MnO2+4H+═Mn2++I2+2H2O,故答案为:2I-+MnO2+4H+═Mn2++I2+2H2O;
剂的选择原理:和水互不相溶,要萃取的物质在其中的溶解度大于在水中的溶解度,可以选择苯,故答案为:苯与水互不相溶 碘在苯中的溶解度比在水中大;
(5)提取碘后的水溶液中若是含有单质碘,则遇到淀粉会变蓝色,可以取少量提取碘后的水溶液于试管中,加入几滴淀粉试液,观察是否出现蓝色(如果变蓝,说明还有单质碘),故答案为:取少量提取碘后的水溶液于试管中,加入几滴淀粉试液,观察是否出现蓝色(如果变蓝,说明还有单质碘).
点评 本题考查海水资源的综合应用,为高频考点,把握实验流程中的反应及混合物分离提纯方法为解答的关键,侧重分析与实验能力的考查,题目难度不大.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | CH2=CH-CH=CH2 1,3-二丁烯 | B. |  3-丁醇 3-丁醇 | ||
| C. | 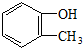 甲基苯酚 甲基苯酚 | D. | 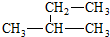 2-甲基丁烷 2-甲基丁烷 |
| A. | 减少少量W,逆反应速率减小 | |
| B. | 当容器中气体的平均相对分子质量不变时,反应达到平衡 | |
| C. | 降低温度,平衡正向移动 | |
| D. | 平衡后加入Z,上述反应的△H减小 |
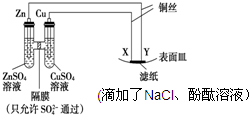
| A. | 电子从Cu极流出,流入X极 | B. | 滤纸中的Cl-向Y极移动 | ||
| C. | Y为滤纸接触处有氢气生成 | D. | X与滤纸接触处变红 |
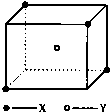 某离子晶体晶胞结构如图所示,x位于立方体的顶点,Y位于立方体中心.试分析:
某离子晶体晶胞结构如图所示,x位于立方体的顶点,Y位于立方体中心.试分析:
 .
.