题目内容
4.下列说法正确的是( )| A. | Cl2是双原子分子,H2S是三原子分子,这是由共价键的方向性决定的 | |
| B. | H2O与H2S的空间结构一样是由共价键的饱和性决定的 | |
| C. | 并非所有的共价键都有方向性 | |
| D. | 两原子轨道发生重叠后,电子在两核间出现的概率减小 |
分析 A.共价键具有饱和性;
B.共价键具有方向性;
C.s-s轨道形成的共价键无方向性;
D.两原子轨道发生重叠后,电子在两核间出现的概率增大.
解答 解:A.S最外层有6个电子,只能结合2个H,形成H2S分子,若写成H3S分子,违背了共价键的饱和性,故A错误;
B.O、S核外电子排布相似,成键方式相同,由共价键的方向性决定的,故B错误;
C.H2分子中H原子的s轨道为球形,无方向性,所以形成的s-s键没有方向性,故C正确;
D.共价键形成时,两个参与成键的原子轨道总是尽可能沿着电子出现概率最大的方向重叠,所以两原子轨道发生重叠后,电子在两核间出现的概率增大,故D错误.
故选C.
点评 本题考查共价键的形成及性质等,为高频考点,把握共价键的形成及电子云的重叠等为解答的关键,侧重分子结构与性质的考查,题目难度不大.

练习册系列答案
 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案
相关题目
15.某温度下,体积一定的密闭容器中进行如下可逆反应:X(g)+Y(g)?Z(g)+W(s);△H>0下列叙述正确的是( )
| A. | 减少少量W,逆反应速率减小 | |
| B. | 当容器中气体的平均相对分子质量不变时,反应达到平衡 | |
| C. | 降低温度,平衡正向移动 | |
| D. | 平衡后加入Z,上述反应的△H减小 |
12.某学习小组利用下列装置探究氯气和氨气之间的反应,其中A、F分别为氨气和氯气的发生装置,C为纯净干燥的氯气和氨气的反应装置.
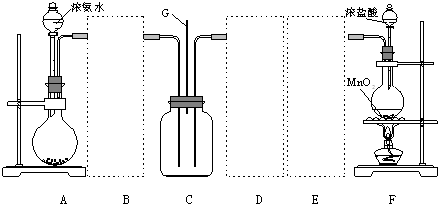
请回答下列问题:
(1)装置A中烧瓶内的固体可选用a、b.
a.烧碱 b.生石灰c.二氧化硅 d.五氧化二磷
(2)往装置A的烧瓶内加入粉末状固体的操作方法是:将烧瓶横放,将盛有药品药匙或小纸槽伸入瓶底,再将烧瓶竖起.
(3)虚线框内应添加必要的除杂装置,请从上图的备选装置中选择并将编号填入下列空格.
B碱石灰;E饱和食盐水(填编号).
(4)装置C内出现白烟并在容器内壁凝结,鉴定该固体是氯化铵所需要的试剂和试纸除蒸馏水外还有NaOH溶液和湿润的红色石蕊试纸;硝酸银溶液和稀硝酸.
(5)如果C中气体未出现红棕色,写出C中发生反应的化学方程式8NH3+3Cl2=6NH4Cl+N2.

| Ⅰ | Ⅱ | Ⅲ | |
| 备选 装置 | 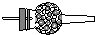 | 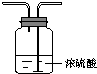 | 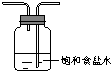 |
(1)装置A中烧瓶内的固体可选用a、b.
a.烧碱 b.生石灰c.二氧化硅 d.五氧化二磷
(2)往装置A的烧瓶内加入粉末状固体的操作方法是:将烧瓶横放,将盛有药品药匙或小纸槽伸入瓶底,再将烧瓶竖起.
(3)虚线框内应添加必要的除杂装置,请从上图的备选装置中选择并将编号填入下列空格.
B碱石灰;E饱和食盐水(填编号).
(4)装置C内出现白烟并在容器内壁凝结,鉴定该固体是氯化铵所需要的试剂和试纸除蒸馏水外还有NaOH溶液和湿润的红色石蕊试纸;硝酸银溶液和稀硝酸.
(5)如果C中气体未出现红棕色,写出C中发生反应的化学方程式8NH3+3Cl2=6NH4Cl+N2.
9.电解含重水(D2O)的普通水.当电路中有4mo1电子通过时.测得两惰性电极上共产生36.5g气体.则在生成的气体中D和H的个数比为 ( )
| A. | 1:4 | B. | 1:5 | C. | 2:5 | D. | 1:7 |
16.如图所示,下列叙述正确的是( )
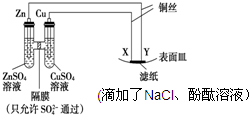

| A. | 电子从Cu极流出,流入X极 | B. | 滤纸中的Cl-向Y极移动 | ||
| C. | Y为滤纸接触处有氢气生成 | D. | X与滤纸接触处变红 |
13.阿魏酸在食品、医药等方面有着广泛用途.一种合成阿魏酸的反应可表示为
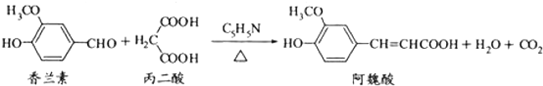
下列说法正确的是( )

下列说法正确的是( )
| A. | 可用酸性KmMO4溶液检测上述反应是否有阿魏酸生成 | |
| B. | 香兰素、阿魏酸均可与Na2CO3、NaOH溶液反应 | |
| C. | 通常条件下,香兰素、阿魏酸都能发生取代、加成、消去反应 | |
| D. | 1mol香兰素最多可以与4molH2发生加成反应 |
14.下列叙述中错误的是( )
| A. | H2SO4的摩尔质量是98 | |
| B. | 2 mol NO和2 mol N2含原子数相同 | |
| C. | 等质量的O2和O3中所含氧原子个数相同 | |
| D. | 等物质的量的CO和CO2中所含碳原子数相等 |
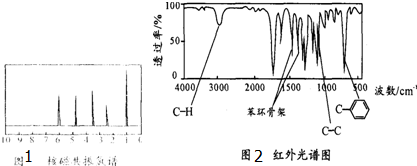
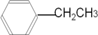 .
. C4H8O2;
C4H8O2;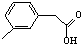 C9H10O2.
C9H10O2.