题目内容
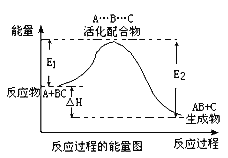
【题目】合成氨化学方程式 N2(g)+3H2(g)![]() 2NH3(g) △H=92.4 kJ/mol。将l mol N2(g)、3 mol H2(g)充入2 L的密闭容器中,在500℃下反应,10 min 时达到平衡,NH3的体积分数为
2NH3(g) △H=92.4 kJ/mol。将l mol N2(g)、3 mol H2(g)充入2 L的密闭容器中,在500℃下反应,10 min 时达到平衡,NH3的体积分数为![]() ,下列说法中正确的是
,下列说法中正确的是

A. 若达到平衡时,测得体系放出9.24 kJ热量,则H2反应速率变化曲线如图甲所示
B. 反应过程中,混合气体平均相对分子质最M,混合气体密度d,混合气体压强p,三者关系如图乙所示
C. 图丙容器I和II达到平衡时,NH3的体积分数![]() ,则容器I放出热量与容器II吸收热量之和为92.4 kJ
,则容器I放出热量与容器II吸收热量之和为92.4 kJ
D. 若起始加入物料为1 mol N2,3 mol H2,在不同条件下达到平衡时,NH3的体积分数变化如图丁所示
【答案】B
【解析】
试题A、达到平衡时放出的热量为9.24kJ,由热化学方程式可知参加反应的氢气的物质的量为0.3mol,10min内氢气的平均速率为0.015mol/(Lmin),反应速率应为由高到低,A错误;B、混合气体的总质量不变,容器的体积不变,混合气体的密度为定值;随反应进行、混合气体的物质的量减小,混合气体的平均相对分子质量增大、混合气体的压强降低,B错误;C、恒温恒容下,容器Ⅱ中按化学计量数转化为N2、H2,可得N21mol、H23mol,容器Ⅰ、容器Ⅱ内为等效平衡。平衡时容器内对应各物质物质的量相等,容器I放出热量与容器II吸收热量之和为92.4kJ,C正确;D、增大压强平衡向正反应方向移动,氨气的体积分数增大,升高温度平衡向逆反应方向移动,平衡时NH3的体积分数减小,D错误,答案选C。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目