题目内容
【题目】某反应过程中体系的能量变化如图所示,下列说法错误的是
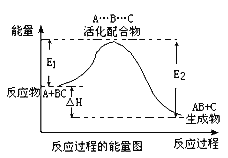
A. 该反应不一定能自发进行
B. E1为反应物的平均能量与过渡态的能量差,称为正反应的活化能
C. 正反应的热效应为△H=E1-E2,且E2>E1,所以正反应为放热反应
D. 加入合适催化剂,△H不变,E1、E2也不变
【答案】D
【解析】
A.由图像可知A+BC=AB+C,△H<0,但该反应熵变△S不一定大于0,所以该反应不一定能自发进行,A项正确;
B.A+BC=AB+C,E1为反应物的平均能量与过渡态的能量差,即反应物成为活化分子所需的最低能量,就是正反应的活化能,B项正确;
C.根据能量转化图可知A+BC=AB+C的反应物总能量大于生成物总能量,该反应为放热反应,所以正反应的反应热△H=-(E2-E1)=E1-E2,E2>E1,△H<0,C项正确;
D.加入合适催化剂可以降低正、逆反应的活化能,即E1、E2均减小,D项错误;答案选D。

练习册系列答案
 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案
相关题目